近年来,大量针对药物释放目的的物理、化学刺激响应微纳米结构被设计和报道出来。各种精细的纳米载体如脂质体,胶束,贵金属纳米颗粒,金属氧化物纳米颗粒和金属-有机纳米等结构已被证明与常规抗肿瘤载体相比,具有更强的治疗效果。然而,由于肿瘤内异常的血管系统和致密胶原基质形成的生理屏障,阻止了纳米载体被运输到肿瘤内部,导致癌症治疗药物递送的有效性被削弱了。
为此,我们设计出一种脂质体药物输送系统,这种装载治疗性气体前体药物茴三硫和磁性纳米颗粒的复合结构通过EPR效应,在外磁场的靶向控制下高效率聚集在肿瘤位置,随后在瘤内CBS、CSE等生物酶的催化下,生成具有抗肿瘤性质的气体-硫化氢。一方面,脂质体装载的磁性纳米颗粒对外磁场特异性响应,可以磁共振成像时空监控和调控脂质体的瘤内靶向聚集;另一方面,酶催化产生的硫化氢微气泡增强了瘤内超声造影效果,进而,更高声强的超声能量可进一步刺激微气泡破裂,超声空化物理肿瘤消融和硫化氢本身的抗肿瘤性质导致原本致密的瘤内组织坏死溶解,为纳米载体进入肿瘤内部创造了有利条件。从而这种脂质体药物纳米系统可以实现超声/磁共振双模态影像监控下的更良好的肿瘤治疗一体化。
Yang Liu, Fang Yang*, Chuxiao Yuan, Mingxi Li, Tuantuan Wang, Bo Chen, Juan Jin, Peng Zhao, Jiayi Tong, Shouhua Luo, and Ning Gu*. Magnetic Nanoliposomes as In Situ Microbubble Bombers for Multimodality Image-Guided Cancer Theranostics. ACS Nano. 2017, DOI: 10.1021/acsnano.6b06815(http://pubs.acs.org/articlesonrequest/AOR-9ittCgYEcvyR5iBtWT7h)
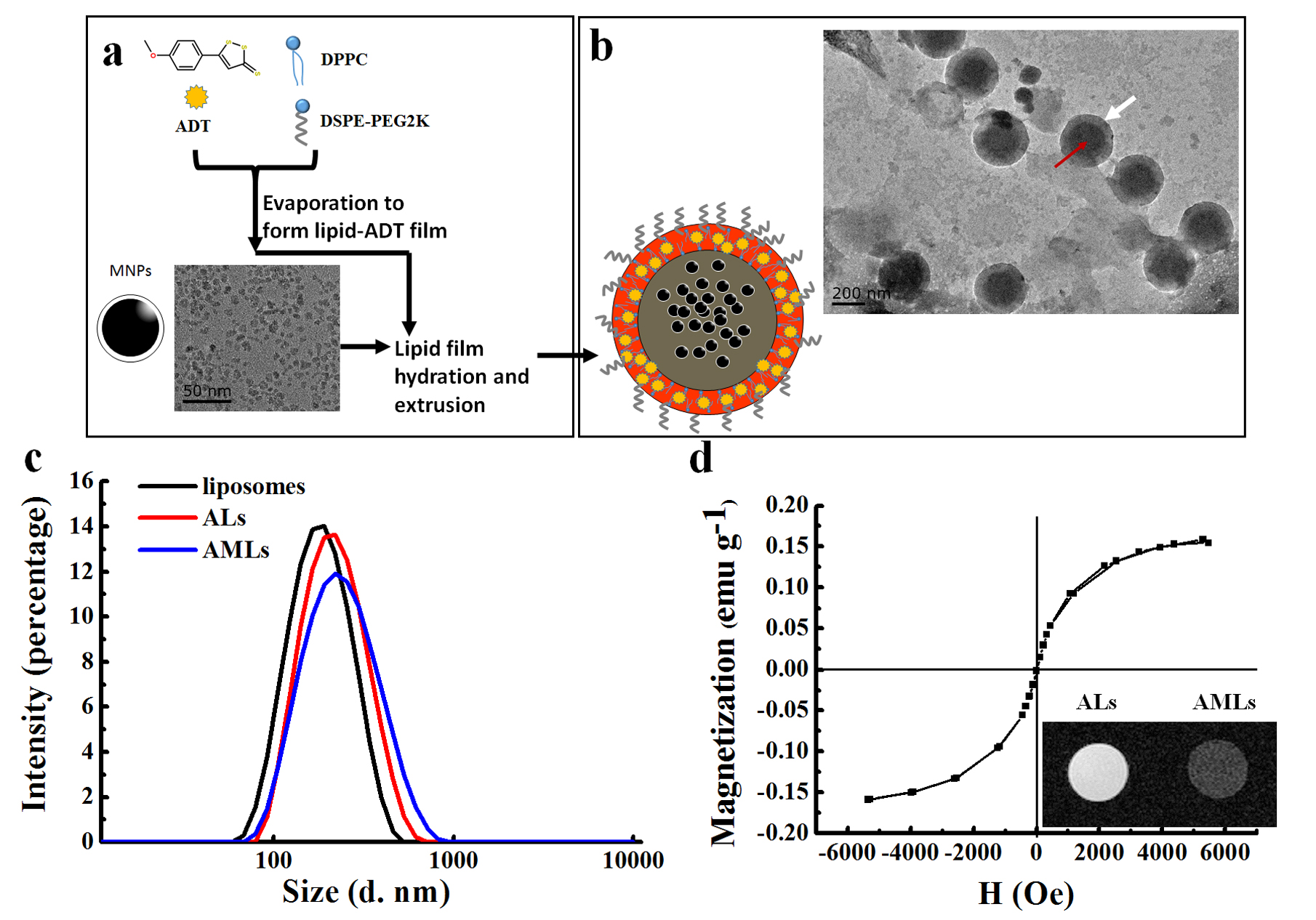
图1 磁性脂质体制备和磁学性能表征。

图2 HepG2细胞内硫化氢气泡的产生活细胞工作站观察。
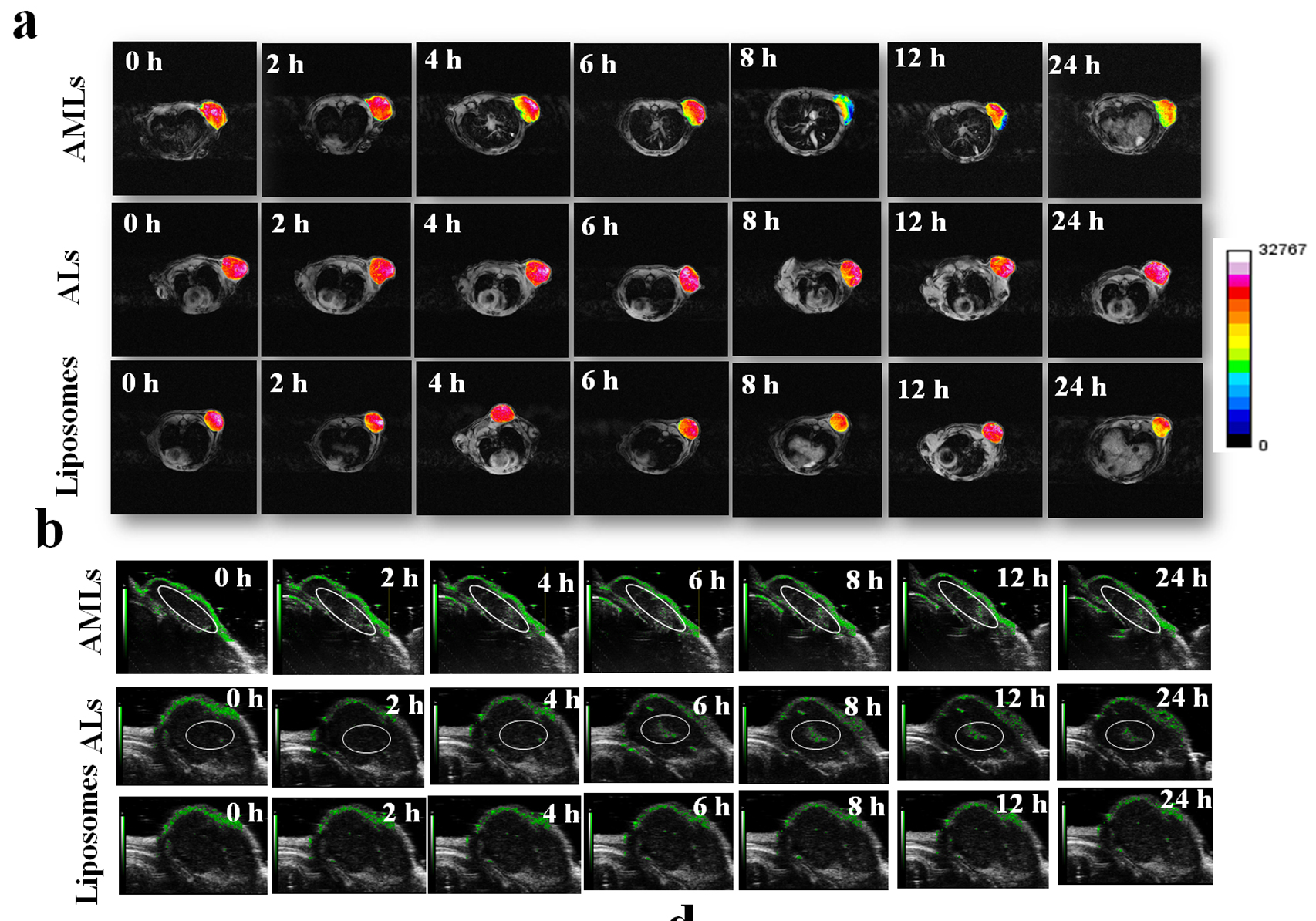
图3 肝癌模型动物体内超声/磁共振双模态成像。
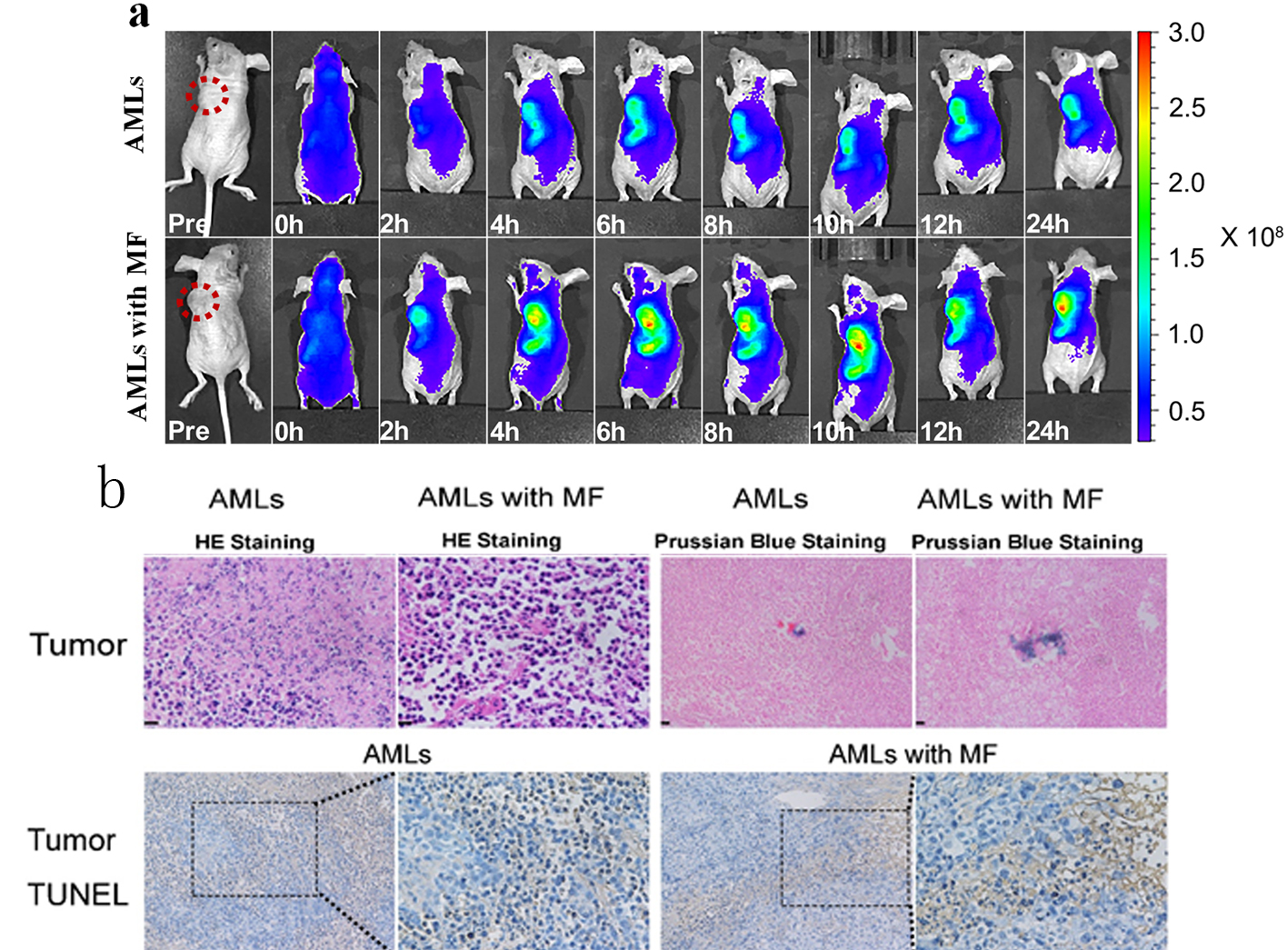
图4 体内分布和肿瘤治疗效果表征。