细胞和再生医学是近年来方兴未艾的生物医学新领域,具有重要的临床应用价值,旨在通过干细胞移植、调控分化与组织再生,促进机体创伤修复和疾病治疗。神经元细胞受损后难以修复导致,是当前神经性疾病治疗的难点。近年来,神经干细胞(NSCs)作为具有自我更新能力和多向分化潜力的多能干细胞,在神经元修复和神经相关疾病的治疗中备受关注,然而,缺乏体内迁移的有效示踪,以及难以调控其体内的存活和分化效率是临床应用面临的两大关键挑战。
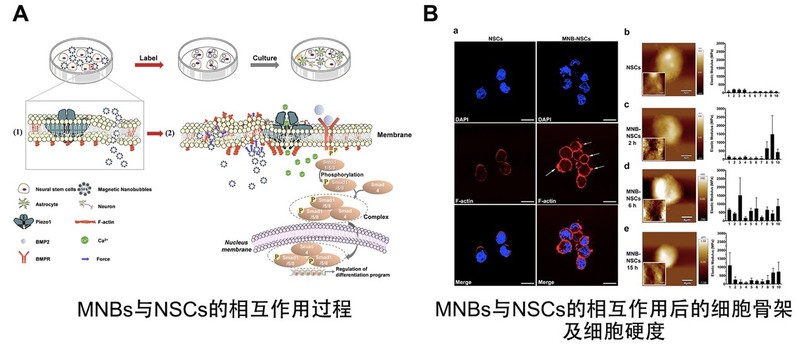
基于前期研究中以γ-Fe2O3为膜壳构建的磁性纳米气泡结构(MNBs),我们发展了一种基于MNBs的气液界面结构特点和超声响应特性,探究了其对NSCs分化命运(尤其是向功能性神经元方向分化)的调控方法和作用机制;进一步在缺血性脑卒中模型中评价了MNBs标记的NSCs(MNB-NSCs)的双模态影像示踪及体内命运发展。结果表明,当MNBs被NSCs内化时,MNBs的细胞内体积变化会改变细胞骨架F-actin的分布和细胞膜的硬度,进而激活细胞膜上的力响应性Piezo1通道,诱发Ca2+内流,序贯触发了BMP2/Smad信号通路,最终导致NSCs开启分化进程。进一步地,通过施加低强度脉冲超声(LIPUS)作用显著促进了NSCs向神经元方向的分化,并加速了分化神经元的突触形成,保证了分化的神经元功能性。以缺血性脑卒中小鼠为模型的体内结果表明,MNB-NSCs移植至卒中病灶后可实现早期超声显影增强效果和长程MRI显影增强效果。在LIPUS的作用下,卒中病灶移植的MNB-NSCs能够更多地向功能性神经元方向的分化、促进了分化神经元的突触形成,为NSCs在缺血性脑卒中的应用提供重要的实验依据。
论文于2022年5月在线发表到Small杂志上(Jing Li, Yao Zhang, Zhichao Lou, Mingxi Li, Lin Cui, Zhenrong Yang, Lijuan Zhang, Yu Zhang, Ning Gu* and Fang Yang*. Magnetic Nanobubble Mechanical Stress Induces the Piezo1-Ca2+-BMP2/Smad Pathway to Modulate Neural Stem Cell Fate and MRI/Ultrasound Dual Imaging Surveillance for Ischemic Stroke. Small, 2022, https://doi.org/10.1002/smll.202201123)