急性髓系白血病(AML)是一组造血干细胞克隆性增殖失调的高度异质性血液系统恶性肿瘤,以骨髓和外周血中原始未成熟的髓细胞异常增生为主要特征,是成人急性白血病中最常见的类型。AML每年全球发病率约为3~4/10万人,且呈现逐年递增趋势。AML传统治疗方案主要包括化疗(蒽环类药物+阿糖胞苷)和造血干细胞移植,虽然AML传统治疗方案取得了一定的治愈率和缓解率,患者很难达到完全缓解和长期无病生存,其主要原因是AML细胞在体内的微量残留、浸润、转移、耐药和复发。目前全球AML患者的长期生存率仍然不高,5年生存率约为27%,而60岁以上患者中位生存期不到一年。大量临床研究显示,骨髓基质细胞分泌的大量CXCL12可以激活AML细胞表面过表达的特异性受体CXCR4,从而诱导AML细胞迁移到骨髓微环境并获得耐药信号。导致大多数AML患者经化疗后体内仍旧残留微量的AML细胞,为后续复发和耐药埋下了隐患,并且传统治疗方案对正常组织的毒副作用也严重限制了AML的临床治疗效果。而一旦复发,耐药性明显增加,预后差,死亡率增高。为了克服AML复发和耐药问题,近日东南大学生物科学与医学工程学院的生物医学纳米技术研究团队联合中国医学科学院基础医学研究所、国家纳米科学中心的研究者,在Nano Today发表“Fe3O4@Ptnanozymes combining with CXCR4 antagonists to synergistically treat acutemyeloid leukemia”文章(第一作者为博士生孔非,通讯作者为许海燕、顾宁和张宇教授),设计了一种Fe3O4@Pt复合纳米酶偶联CXCR4拮抗剂的多功能纳米平台,为协同治疗AML提供了新的策略。
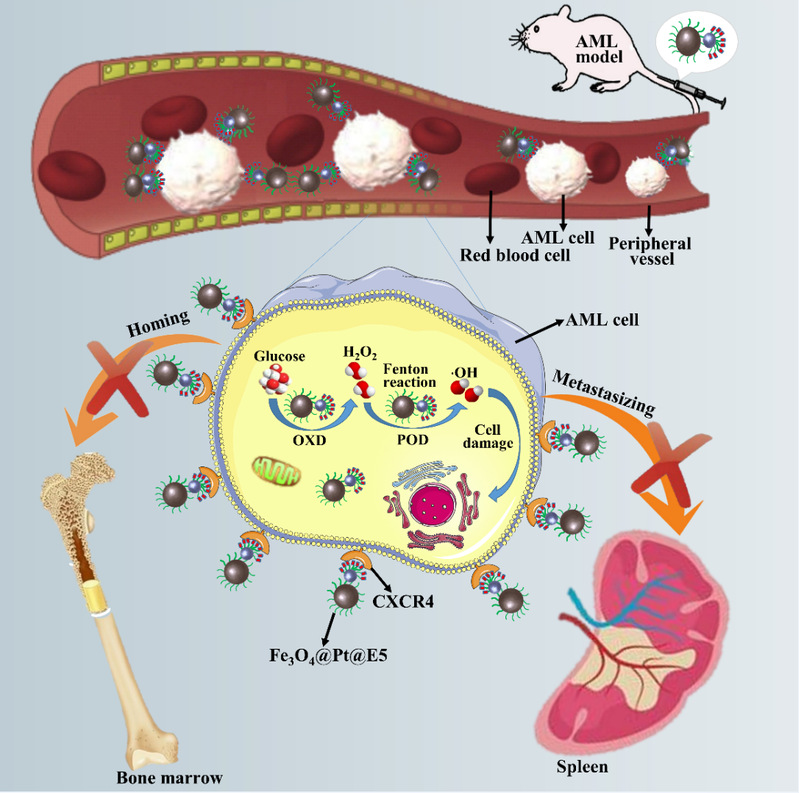
图1.基于Fe3O4@Pt复合纳米酶和CXCR4拮抗剂协同治疗AML示意图
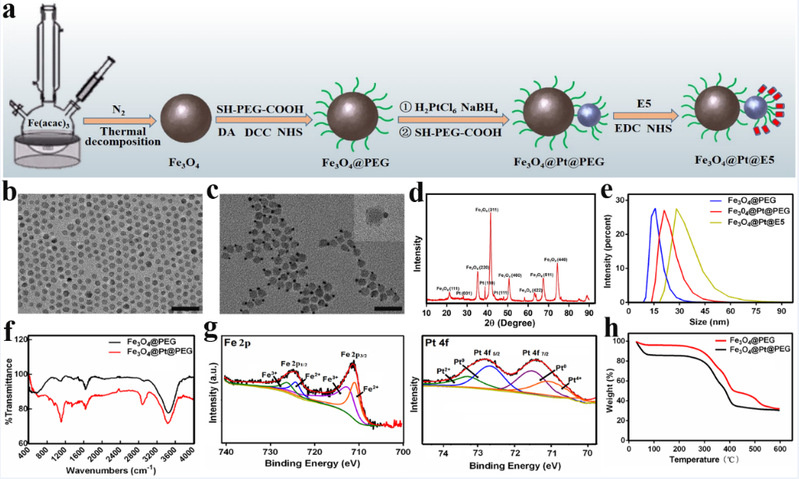
图2.Fe3O4@Pt@E5纳米颗粒的合成与表征
本研究通过将Fe3O4纳米颗粒与Pt纳米颗粒通过聚乙二醇(PEG)修饰与链接而形成二元复合结构,Pt纳米颗粒一侧通过共价键连接CXCR4拮抗多肽(E5)。成功制备了一种能够产生大量ROS的级联纳米酶(Fe3O4@Pt@E5)。该级联纳米酶具有Janus结构,形貌尺寸均匀(Fe3O48.0 ± 1.0 nm,Pt 2.0 ± 0.5 nm),具有良好的稳定性与生物相容性(图2)。通过对各种酶活性测试(图3),证明了级联纳米酶类似天然酶,具有过氧化物酶、过氧化氢酶、氧化酶以及超氧化物歧化酶多酶活性。其酶催化活性与浓度、时间密切相关,具有温度和pH依赖性,在pH = 4.0时过氧化物酶活性最高,而过氧化氢酶活性在碱性环境下最佳。Fe3O4@Pt复合纳米酶所产生的·OH比单独的Fe3O4、Pt纳米酶更多,并且与Fe3O4、Pt纳米酶相比,Fe3O4@Pt复合纳米酶的酶催化活性最强。
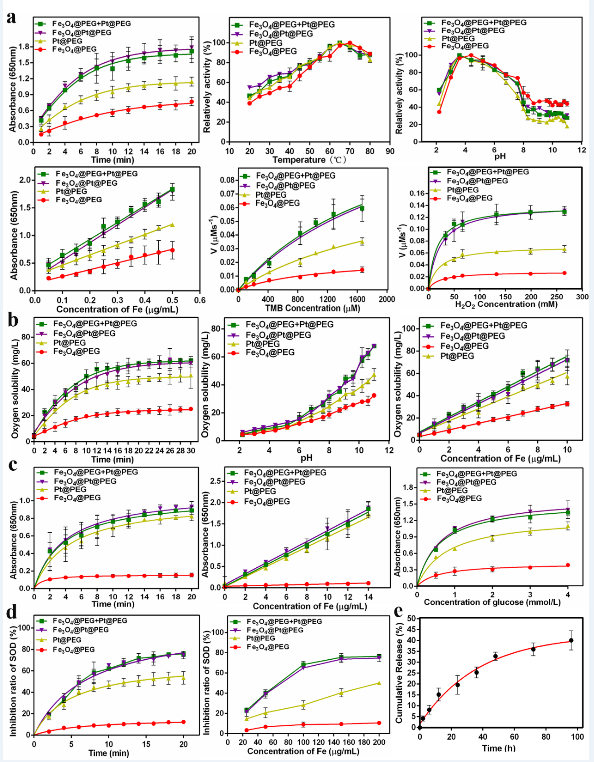
图3.Fe3O4@Pt@E5纳米颗粒的多种模拟酶活性验证。(a)纳米颗粒的类过氧化物酶活性;(b)纳米颗粒的类过氧化氢酶活性;(c)纳米颗粒的氧化物活性;(d)纳米颗粒的超氧化物歧化酶活性;(e)纳米颗粒的铂离子累积释放曲线。
Fe3O4@Pt@E5能够通过E5有效地靶向到AML细胞,并进入AML细胞溶酶体内(图4), 通过级联催化反应产生大量ROS(图5)。首先Pt纳米颗粒模拟氧化酶的催化活性,促进葡萄糖转化为葡糖酸和H2O2。同时,在微酸性溶酶体内,Fe3O4和Pt纳米颗粒均表现出类过氧化物酶活性,实现了高效地协同催化,催化H2O2转化为剧毒·OH,有效杀伤AML细胞。此外,E5作为CXCR4拮抗剂还可干扰CXCR4/CXCL12信号通路,从而有效阻止AML细胞向骨髓的粘附、迁移。
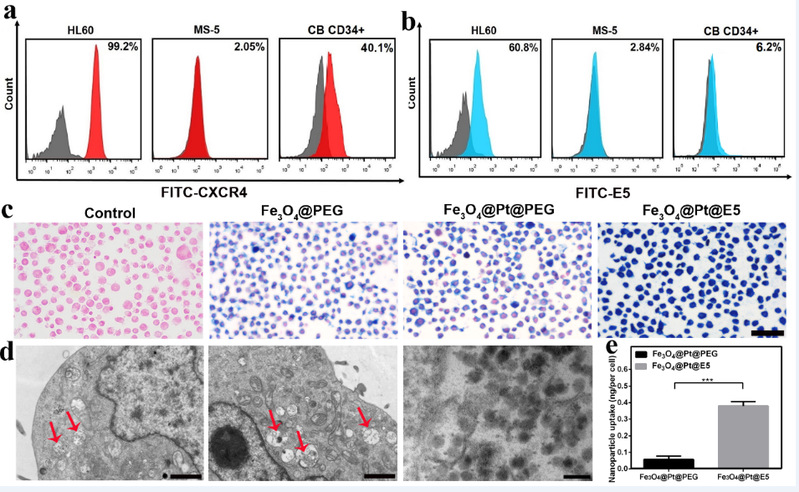
图4.纳米颗粒的靶向能力和细胞摄取情况。(a)流式细胞术分析CXCR4在不同细胞中的表达水平;(b)E5对不同细胞的亲和力;(c)普鲁士蓝染色检测纳米颗粒对HL-60细胞的靶向能力,比例尺:50 μm;(d)HL-60细胞与Fe3O4@Pt@E5共孵育4 h后的生物透射电镜图;(e)ICP-MS定量测定细胞内纳米颗粒的摄取。
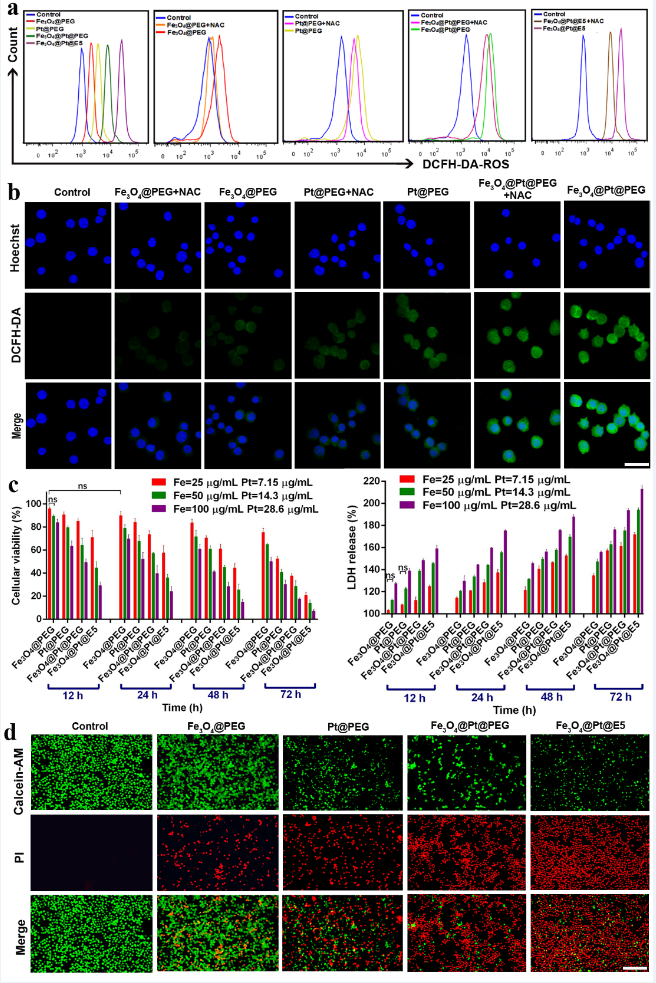
图5. AML细胞中ROS水平及纳米颗粒的细胞毒性。(a)流式细胞术检测AML细胞中ROS水平;(b)细胞内ROS水平荧光图像,比例尺:30 μm;(c)CCK-8法和LDH法检测AML细胞活力;(d)荧光显微镜观察HL-60细胞荧光图像,比例尺:100 μm。
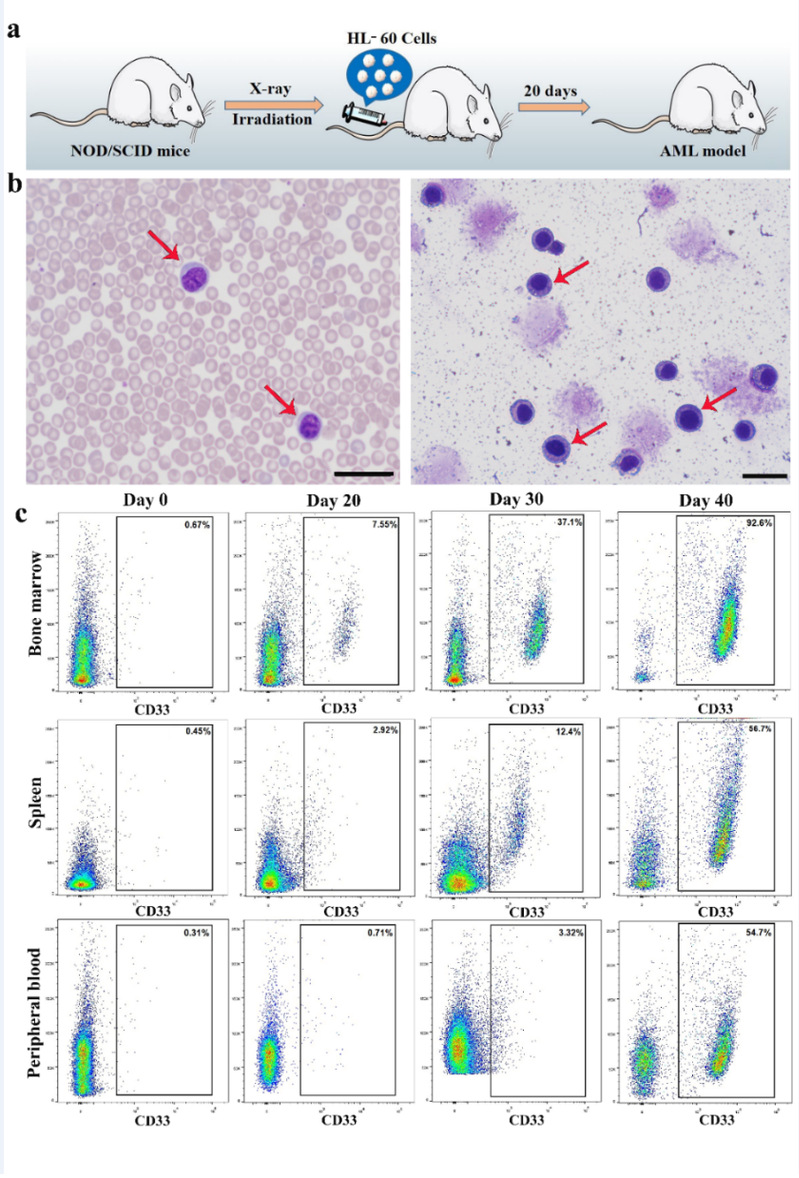
图6. AML小鼠模型的建立。(a)AML小鼠模型的构建过程;(b)外周血和骨髓腔涂片的瑞士-吉姆萨染色;(c)流式细胞术检测骨髓、脾脏和外周血中AML细胞的比例。
本文成功构建了AML小鼠模型去验证Fe3O4@Pt@E5在体内的治疗效果(图7)。Fe3O4@Pt@E5显著提高了AML治疗效果,明显降低了AML细胞在骨髓、脾脏和外周血中的比例,尤其外周血和脾脏中的AML细胞几乎被完全清除。与PBS组(41天)相比,Fe3O4@Pt@E5明显延长了小鼠的生存时间(68天)。Fe3O4@Pt@E5减少了AML细胞向肝、脾内的浸润,有效缓解了AML症状。Fe3O4@Pt@E5在体内具有较长的血液循环时间,血液循环半衰期(t1/2)约为12.5h。Fe3O4@Pt@E5纳米颗粒在体内主要通过肝、脾代谢,并且Fe3O4@Pt@E5纳米颗粒能够进入小鼠的骨髓腔,靶向骨髓内残留的AML细胞并诱导细胞死亡。
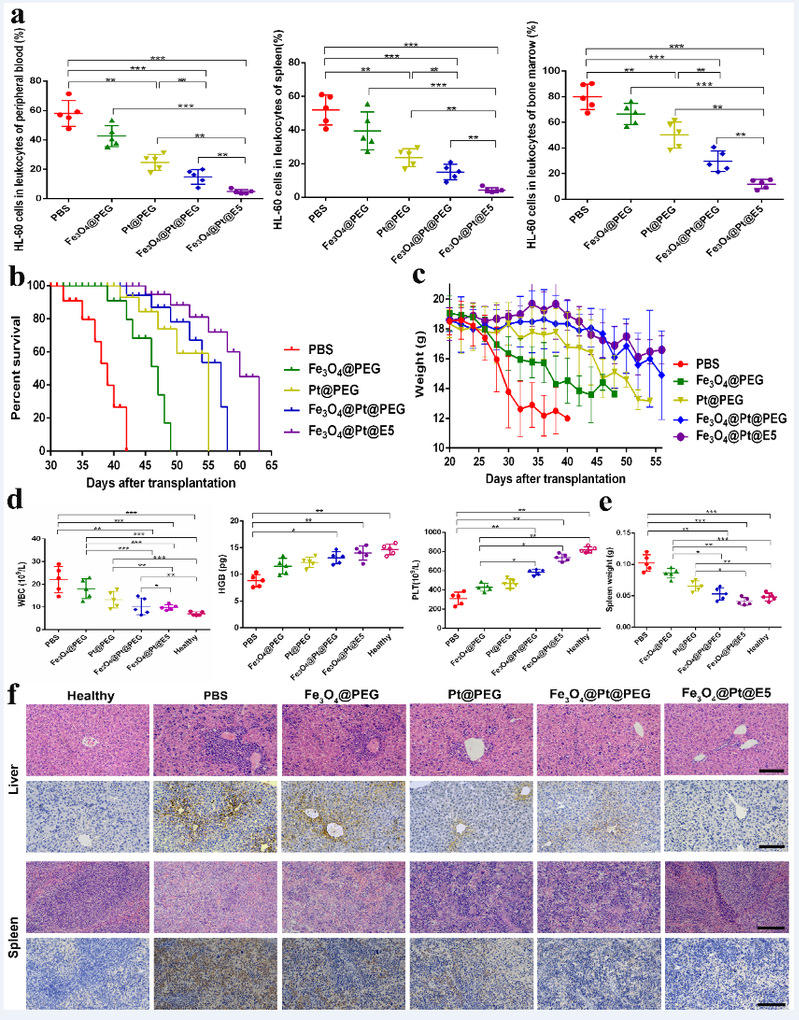
图7. Fe3O4@Pt@E5纳米颗粒对AML小鼠的治疗效果。(a)AML小鼠骨髓、脾脏和外周血中AML细胞的百分比;(b)AML小鼠的生存曲线(n=7);(c)治疗期间小鼠的体重变化;(d)AML小鼠血常规(WBC、HGB、PLT,n=5)检测;(e)AML小鼠脾脏重量(n=5);(f)纳米颗粒对AML细胞浸润肝、脾的体内影响,比例尺:100µm。
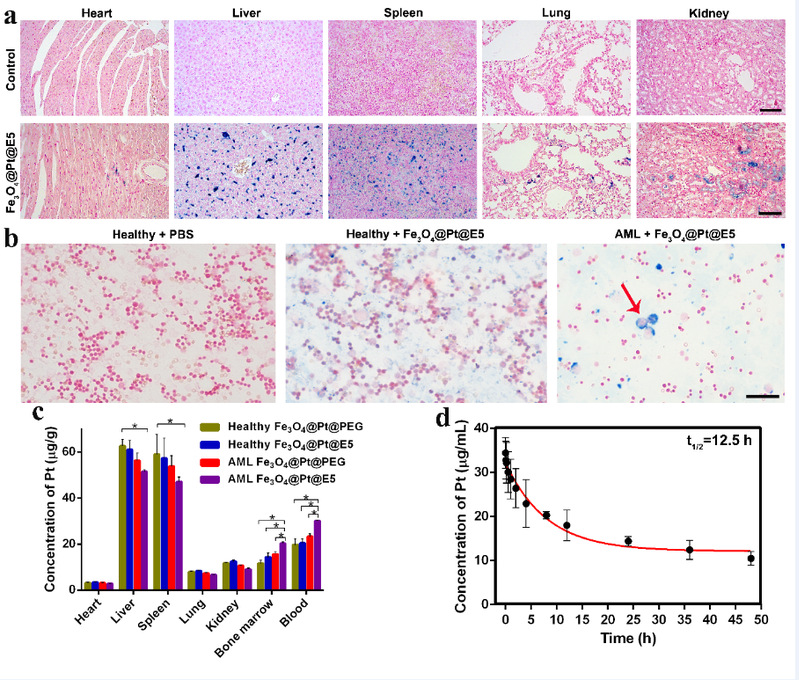
图8. Fe3O4@Pt@E5纳米颗粒在体内的代谢、药代动力学及生物分布。(a)主要脏器(心、肝、脾、肺、肾)切片的普鲁士蓝和核固红双染图像,比例尺:100µm;(b)髓腔积液普鲁士蓝和核固红双染图像,比例尺:50µm;(c)心、肝、脾、肺、肾、骨髓中的铂含量;(d)Fe3O4@Pt@E5(n = 5)的血液清除率曲线,t1/2为12.5 h。
总结
本文结合纳米酶与CXCR4拮抗剂,成功设计了一种协同治疗AML的多功能纳米平台。证明了复合纳米酶通过级联催化反应产生大量的ROS,诱导AML细胞凋亡,E5多肽作为CXCR4/CXCL12轴拮抗剂具有特异性靶向AML细胞的能力。该纳米平台在小鼠模型上展现出理想的AML治疗效果,具有较长的血液循环时间,减轻了肿瘤负担,防止AML细胞归巢到骨髓,抑制AML细胞转移或粘附,从而有效延长AML了小鼠的生存期,并缓解了对正常器官组织的毒副作用。因此,这种纳米平台在AML治疗中具有巨大潜力,并为AML预后提供了新的武器。
发表信息:
Fei kong, Huiyuan Bai, Di Liu, Yi Chen,Linlin Zhuang, Ming Ma, Chen Wang, Haiyan Xu*, Ning Gu*, Yu Zhang *,Fe3O4@Pt nanozymes combining with CXCR4antagonists to synergistically treat acute myeloid leukemia, Nano Today, 2021,37, 101106