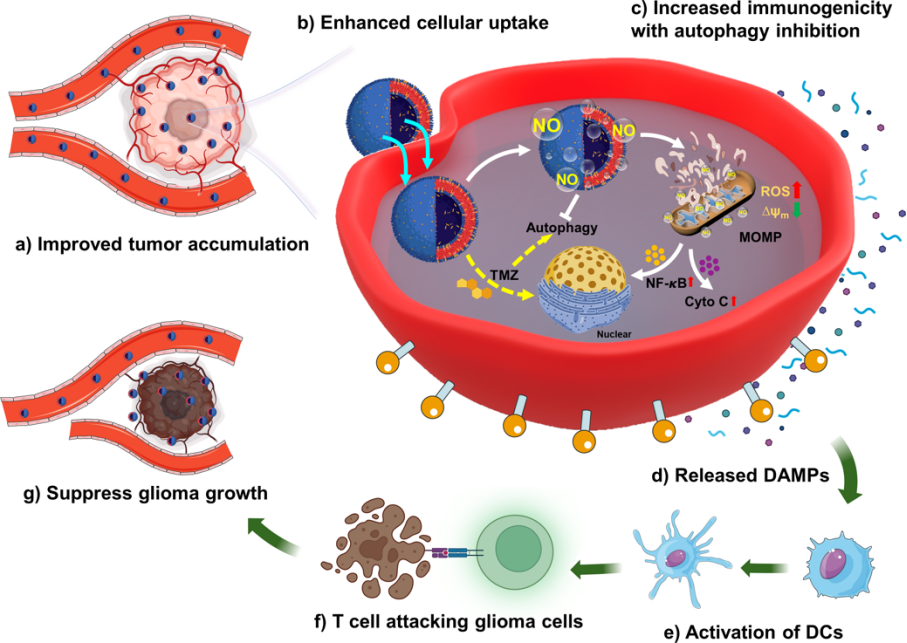
胶质母细胞瘤(GBM)是恶性程度最高的脑胶质瘤,其死亡率居高不下。免疫疗法极大的影响了多种肿瘤的治疗方式,但其对于GBM患者的预后改善并不显著。主要原因可能是由于GBM细胞增强的自噬途径通过降低肿瘤细胞的免疫原性塑造了严重的免疫抑制微环境,极大地削弱了抗肿瘤免疫反应。因此,提高GBM的免疫原性,同时抑制其自噬保护能力以逆转脑胶质瘤的免疫抑制微环境,对于提高GBM患者的治疗预后具有现实意义。
在我们前期构建的新型跨血脑屏障纳米递送平台的基础上(Advanced Materials, 2021, 33 (30): 2101701),本研究设计合成一种装载了GBM化疗药物替莫唑胺(TMZ)与NO前体药物JS-K的纳米脂质体靶向递送体系(S1P/JS-K/TMZ/Lipo)。实验结果显示,S1P/JS-K/TMZ/Lipo在脑胶质瘤细胞内特异性产生的NO发挥了增强药物化疗效果与肿瘤免疫原性的双重功能:一方面NO通过抑制细胞的自噬增强了TMZ的化疗杀伤效果;另一方面,NO通过诱导线粒体功能障碍引发了胶质瘤细胞中损伤相关的分子模式因子(DAMPs)的释放,自噬被抑制的肿瘤细胞顺利发生了免疫原性死亡(ICD),其免疫原性提高。在原位脑胶质瘤荷瘤小鼠模型的体内研究也表明,S1P/JS-K/TMZ/Lipo的治疗相较与仅TMZ或NO治疗组,改善了脑胶质瘤组织中DC、CD3+CD8+ T细胞等免疫细胞的浸润,增强了机体的抗肿瘤免疫反应,有效提高了荷瘤小鼠的生存时间。
相关研究结果以“In Situ Nitric Oxide Gas Nanogenerator Reprograms Glioma Immunosuppressive Microenvironment”为题已在线发表在Advanced Science (https://doi.org/10.1002/advs.202300679, First published: 21 April 2023),刘洋博士后为该论文第一作者,顾宁教授与杨芳教授为通讯作者。