动脉粥样硬化斑块破裂诱发的心肌梗塞和中风等心血管疾病是我国居民的首要死因,给患者家庭和社会都带来沉重的经济负担。目前临床药物主要是他汀类降脂药物,但即使在达到目标血脂后,斑块内产生的炎症仍会增加患者的急性事件风险。最新临床数据显示抗炎药物可预防斑块破裂,降低临床急性事件的发生率,然而全身性炎症抑制会干扰机体免疫系统,增加患者感染风险。因此,寻找安全有效的抗炎策略是当前动脉粥样硬化疾病治疗的研究重点。研究表明,斑块内炎性微环境是造成炎症持续存在的重要因素。斑块内的炎性微环境(包括单核细胞的大量招募、过度氧化应激和凋亡细胞堆积等特征)会持续激活并维持炎症反应。因此,斑块微环境调控已成为动脉粥样硬化治疗的新靶点,针对并消除斑块微环境中的这些炎性特征正成为一种新型的动脉粥样硬化治疗方法。

动脉粥样硬化斑块(来源:网络)
本研究基于实验室前期普鲁士蓝纳米酶的研究基础,取得了一项在改善动脉粥样硬化斑块内炎性微环境方面的重要突破。成功设计了一种具有动脉粥样硬化斑块靶向能力的普鲁士蓝纳米酶(PBNZ@PP-Man)。在这项研究中,对普鲁士蓝纳米颗粒进行了表面修饰,以增强其在体内对动脉粥样硬化斑块的靶向性。PBNZ@PP-Man通过竞争性结合到受损血管内皮高表达的P选择素上,成功降低了斑块内单核细胞的黏附和浸润程度。同时,通过表面修饰的甘露糖分子,这种靶向纳米酶能够精准识别斑块内的炎症细胞,并发挥普鲁士蓝纳米酶的活性氧(ROS)清除能力,从而全面改善动脉粥样硬化斑块内的炎性微环境,进一步稳定斑块形成。在动物模型实验中,PBNZ@PP-Man不仅能有效降低斑块内单核细胞的黏附和浸润,还能发挥普鲁士蓝纳米酶本身的ROS清除活性,有效抑制斑块内的炎症反应,从而促进斑块的稳定化过程。值得注意的是,与仅消除斑块内单一炎性靶点相比,PBNZ@PP-Man在调控炎性斑块微环境和减轻动脉粥样硬化方面的效果更为显著。这一研究可为改善动脉粥样硬化斑块微环境提供了一种新策略。相关工作以《Design of a Multifunctional Nanozyme for Resolving the Proinflammatory Plaque Microenvironment and Attenuating Atherosclerosis》为题发表在ACS Nano上,并被选为Supplementary Journal Cover。该研究得到了国家自然科学基金项目(82072067、61821002、51832001、82202321)、科技部重点研发计划(2017YFA0205502、2022YFF0710800)和江苏省前沿引领技术基础研究专项(BK20222002)的共同资助。
原文链接:https://pubs.acs.org/doi/10.1021/acsnano.3c01420

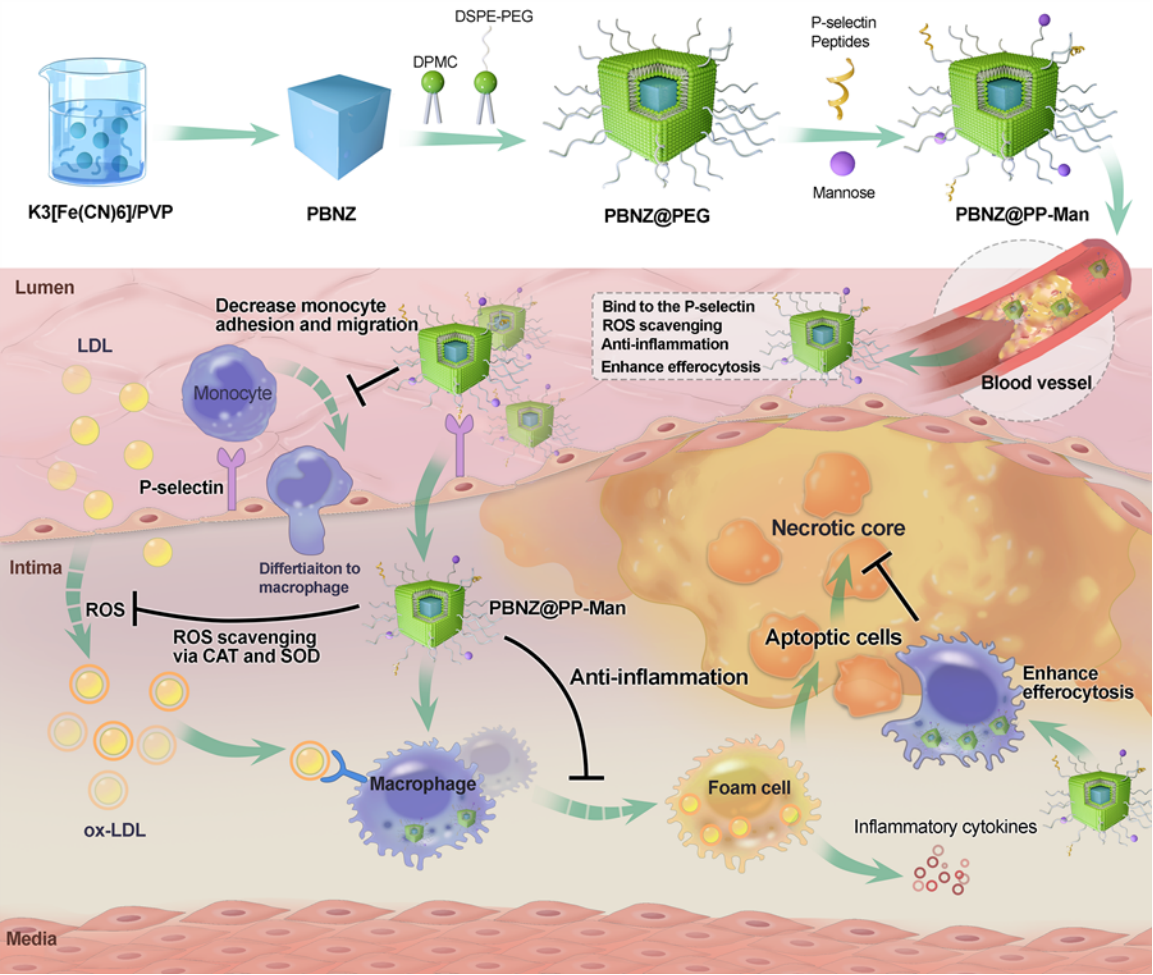
图PBNZ@PP-Man缓解斑块炎性微环境作用机制