前言:
纳米酶催化机制十分复杂,尽管铁基纳米酶已被广泛应用于疾病诊疗、环境治理等多个领域,阐明催化原理对该类纳米酶的设计与应用仍具有重要指导意义。实验室张宇教授课题组以四氧化三铁(Fe3O4)和普鲁士蓝(PB)两个代表性铁基纳米酶为主要研究对象,在其多酶活性发现和催化机制研究中深耕多年,取得了一系列重要成果。
课题组于2012年报道了Fe3O4纳米酶的双酶活性(ACSNano,2012,高被引论文):Fe3O4纳米酶不仅在酸性条件下具有过氧化物酶(POD)活性,还在中性条件下表现出过氧化氢酶(CAT)活性[1]。此研究指出了Fe3O4纳米酶的细胞内定位与其细胞效应之间的重要关系:定位于溶酶体的Fe3O4纳米酶处于酸性微环境,故发挥POD酶活性对细胞进行杀伤;而当Fe3O4纳米酶处于中性的细胞质时,其表现出CAT酶活性而发挥清除ROS、保护细胞的功能(图1)。
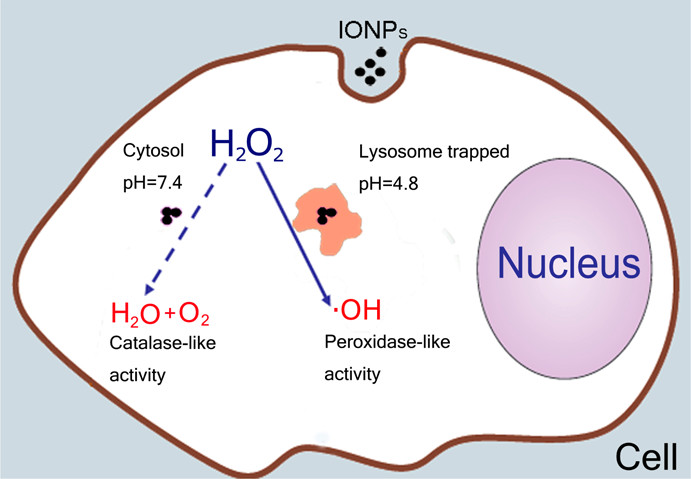
图1 Fe3O4纳米酶多酶活性与细胞效应示意图
在Fe3O4纳米酶的催化机制(Nat Commun, 2022,高被引论文)研究方面,课题组通过循环催化实验首次揭示了Fe3O4纳米酶发挥POD酶活性时表面活性位点消耗及内部电子、Fe3+外迁过程[2]。该工作打破了催化反应仅与纳米酶表界面性质相关的传统观念,指出了纳米酶内部组分对催化反应的重要贡献(图2)。进一步地,课题组提出了基于放疗辐照的电子补充策略(ACSNano,2023),放疗增敏剂HfO2纳米颗粒与Fe3O4纳米酶的复合有效提升了Fe3O4纳米酶的催化可持续性,使得该复合纳米酶表现出了更好的放射化学动力治疗与免疫增强抗肿瘤效果(图3)[3]。
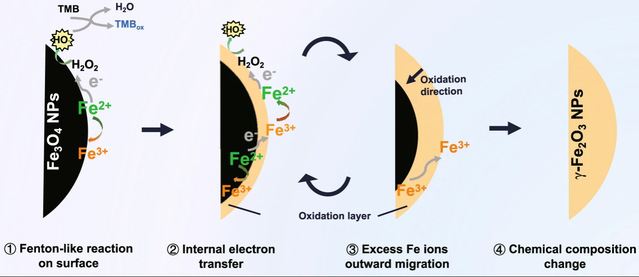
图2可消耗Fe3O4纳米酶POD催化机制示意图
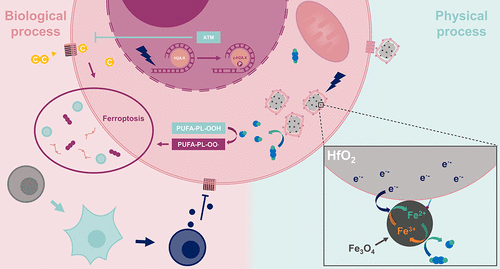
图3 HfO2-Fe3O4复合纳米酶抗肿瘤机制示意图
作为铁基纳米酶的另一典型材料,PB的多酶活性于2016年被课题组首次报道。研究发现PB纳米酶在酸性条件下具有POD酶活性,中性条件下表现CAT酶活性,此外PB纳米酶还展现出超氧化物歧化酶(SOD)活性以及羟基自由基清除能力。推断PB纳米酶的类酶催化过程基于PB/柏林绿(BG)/普鲁士黄(PY)和底物之间的电子转移,并满足氧化还原电位匹配机制(图4)[4]。同时,还发现其通过其多酶活性与细胞内活性氧(ROS)相互作用,在巨噬细胞、内皮细胞、肾小球系膜细胞、神经元细胞等多个细胞氧化应激模型及动物炎症模型(肝炎、糖尿病肾炎)中验证了其广泛的清除ROS和抗氧化功能。研究结果作为封面文章发表在美国化学会顶刊(JACS,2016,高被引论文),还被JACS Spotlight报道,审稿人给予了高度的评价:“It is an interesting work that is part of a prolific and exciting theme on the use of PBNPs for applications in the biomedical field”。最近,课题组将普鲁士蓝纳米酶成功用于改善动脉粥样硬化斑块内炎性微环境并取得重要突破(ACS Nano,2023,封面文章)。成功设计了一种具有动脉粥样硬化斑块靶向能力的普鲁士蓝纳米酶(PBNZ@PP-Man),通过竞争性结合到受损血管内皮高表达的P选择素上,成功降低了斑块内单核细胞的黏附和浸润程度。同时,通过表面修饰的甘露糖分子,这种靶向纳米酶能够精准识别斑块内的炎症细胞,并发挥普鲁士蓝纳米酶的活性氧(ROS)清除能力,从而全面改善动脉粥样硬化斑块内的炎性微环境,进一步稳定斑块形成[5]。
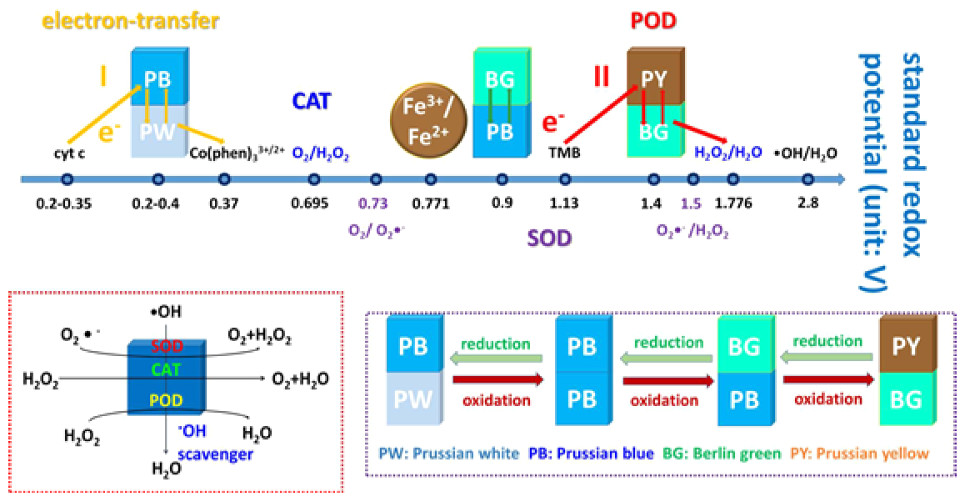
图4 PB纳米酶多酶活性与基于氧化还原电位匹配的电子转移机制
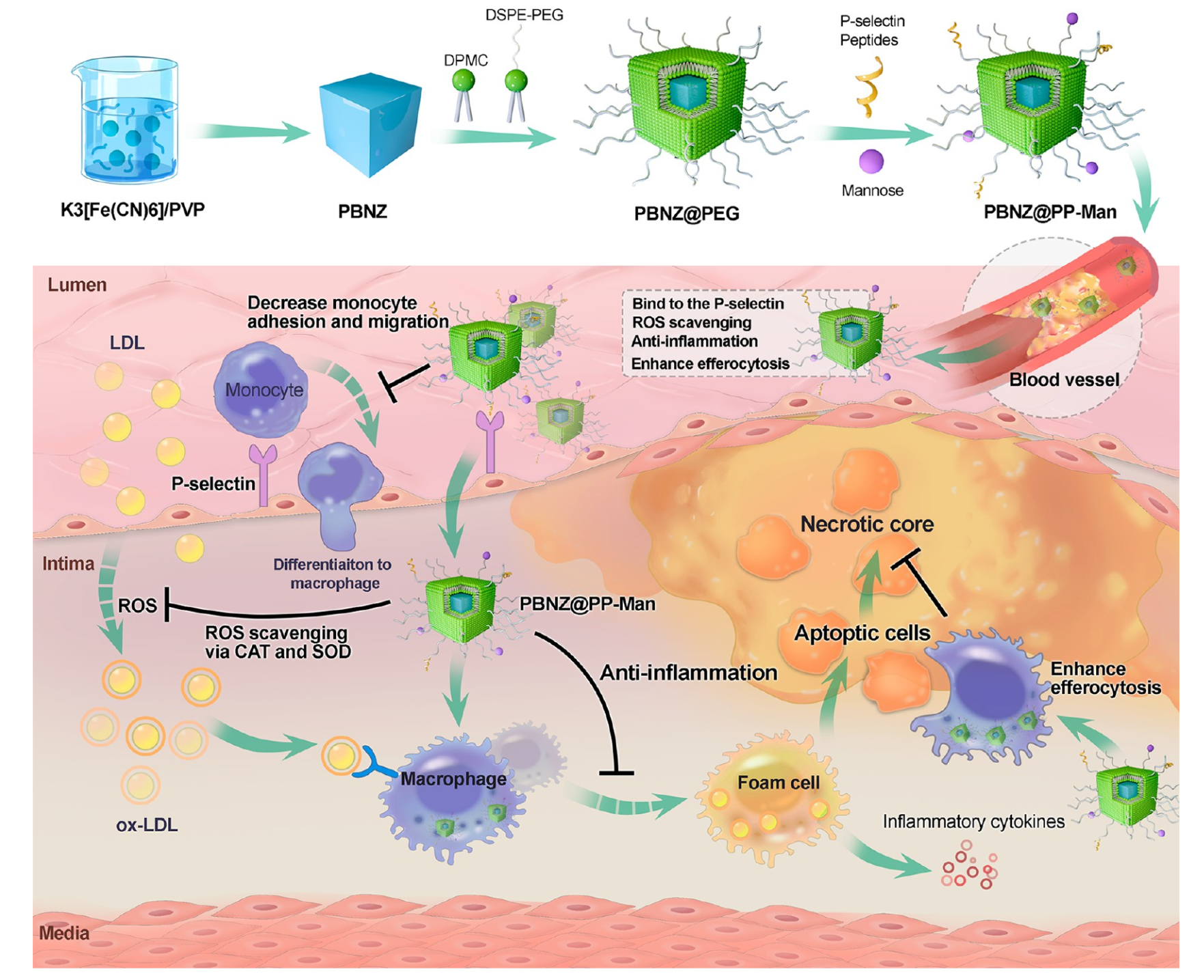
图5多功能普鲁士蓝纳米酶构建及用于改善动脉粥样硬化斑块内炎性微环境
新突破(NatCommun,2024):
催化机制研究是纳米酶理性设计和应用的基础,相较于活性中心明确可调的单原子纳米酶,阐明组分及结构复杂的传统纳米酶催化机制具有极大挑战性。为了阐明PBNZ催化机制,张宇教授课题组建立了长时程催化机制研究策略,系统研究了PBNZ在催化过程中的酶活性变化及表面结构转变。实验表明,经过长时程催化回收的PBNZ酶活性并没有减低,反而有所提升,H2O2使得PBNZ表面Fe价态升高、含氧基团增加。能带分析和理论计算共同表明,PBNZ表面的不可逆预氧化过程活化了催化过程中基于PBNZ价/导带的电子转移双路径(图6),从而增强了PBNZ的类酶活性。

图6基于PBNZ价带(VBP)和导带(CBP)的类酶催化电子转移双路径
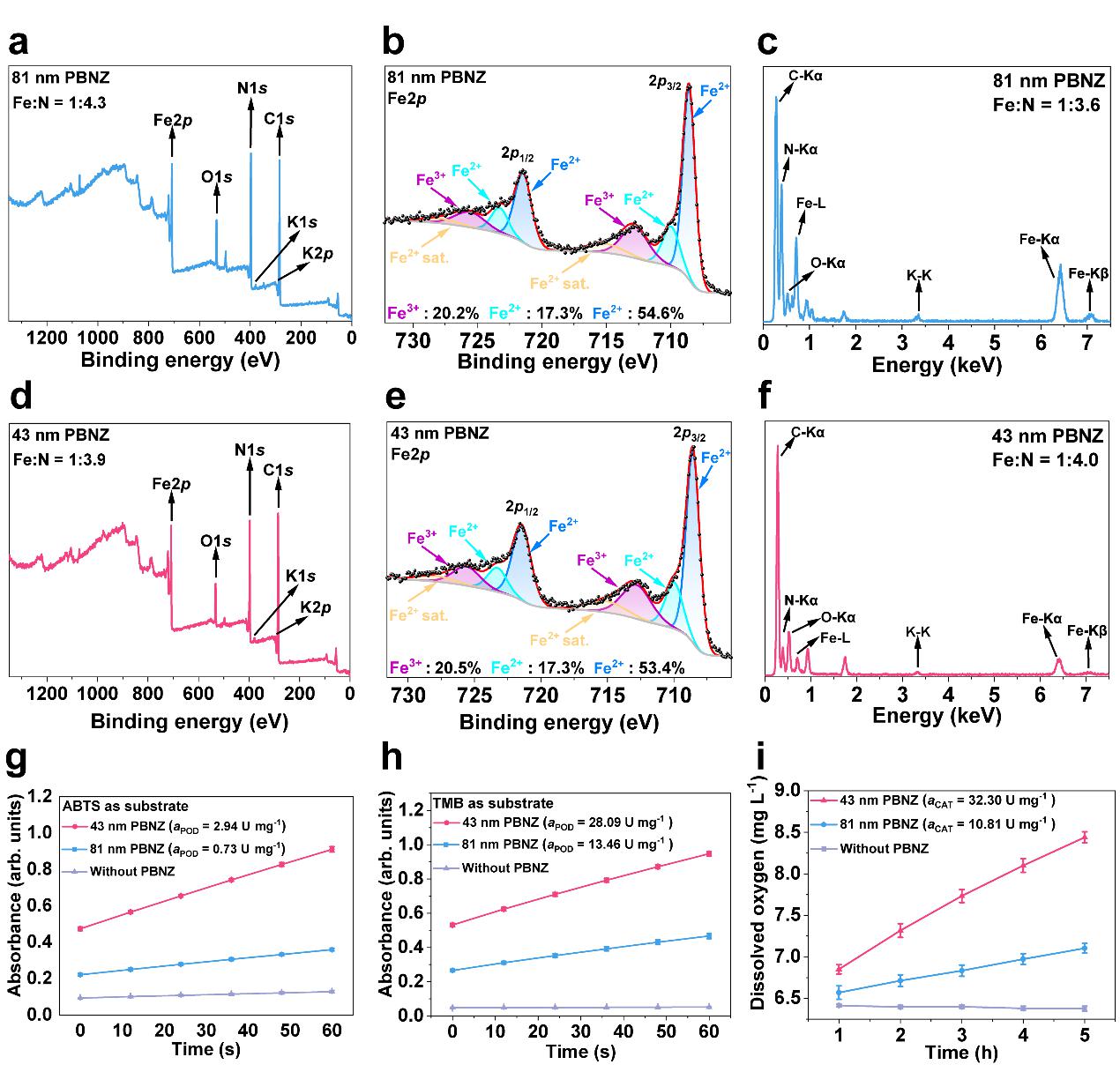
图7 PBNZ表面理化性质表征
如图7所示,81 nm和41 nmPBNZ表面含有大量C配位Fe2+、少量N配位Fe2+及少量N配位Fe3+,此外41 nm PBNZ因其较大的比表面积而具有较高的类过氧化物酶(POD)活性和类过氧化氢酶(CAT)活性。
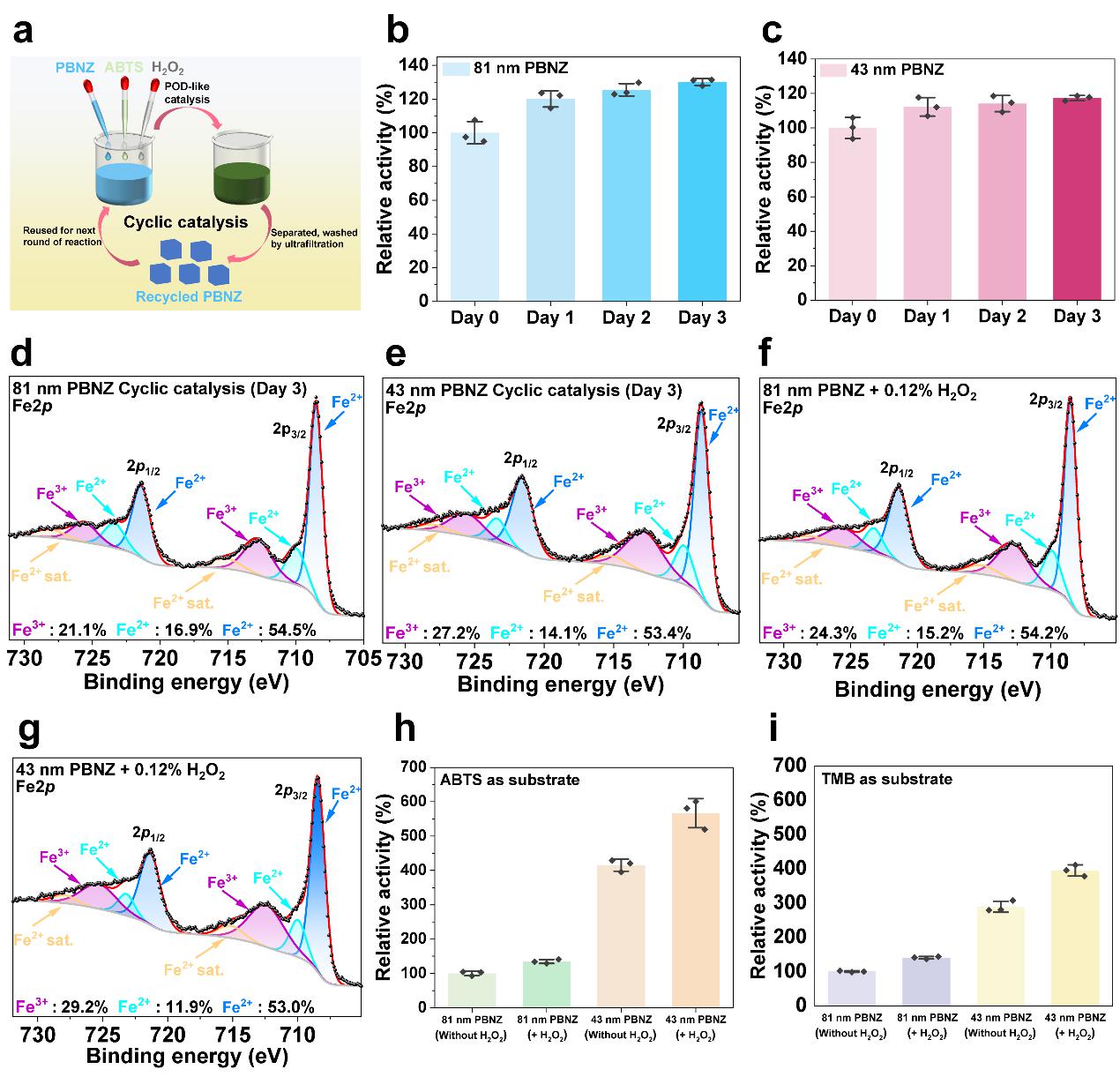
图8 POD长时程催化回收的PBNZ理化性质表征
如图8所示,在经历长达72小时的POD类酶催化反应后,回收的PBNZ催化活性不仅没有减弱,反而略有增强。该现象与课题组此前报道的酶活性消耗的Fe3O4纳米酶(Nature Communications, 2022)相异,预示着PBNZ与Fe3O4所不同的催化机制。实验表明,H2O2对PBNZ的氧化作用可提升其表面Fe3+含量并增强其POD类酶活性。
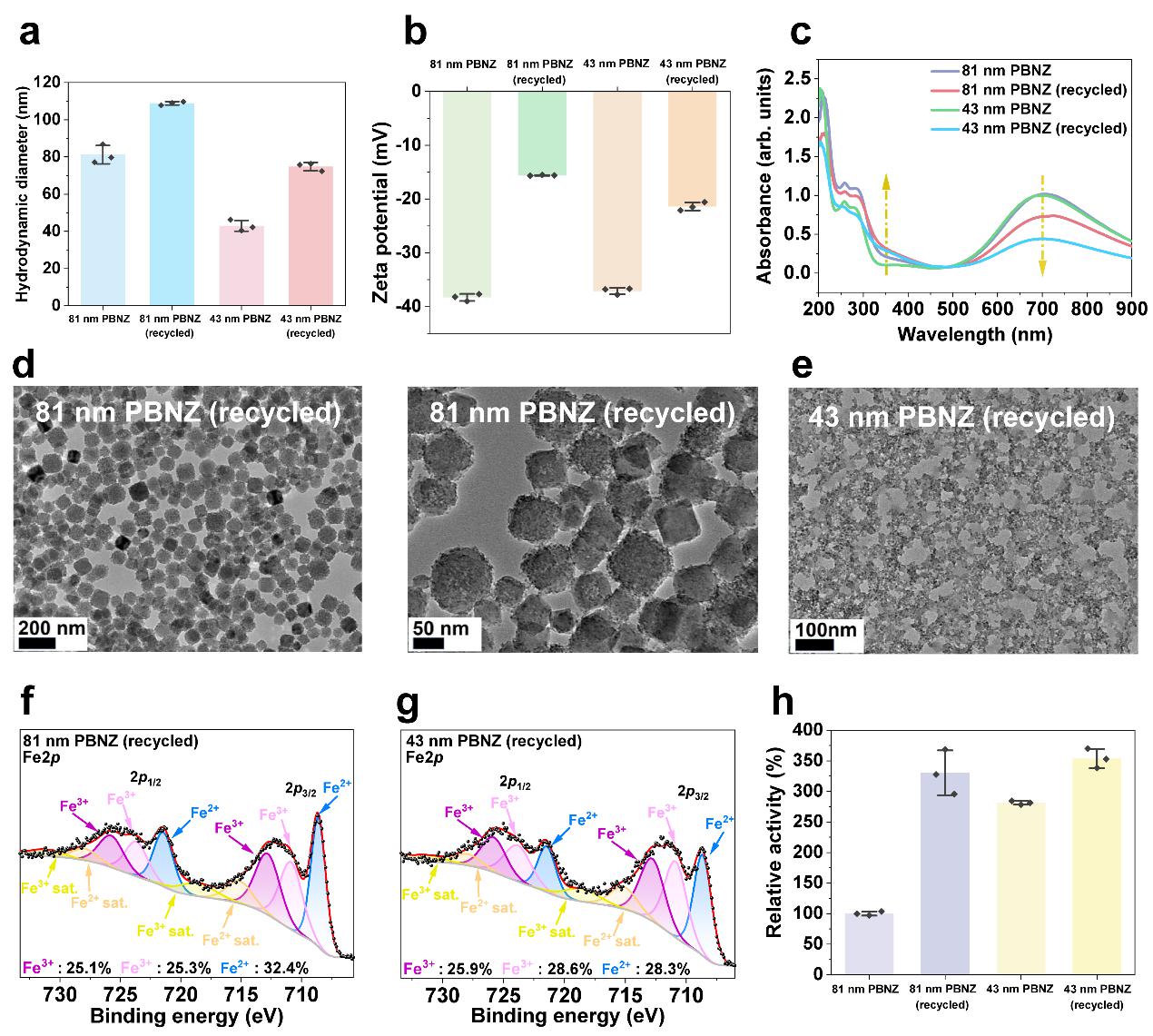
图9 CAT长时程催化回收的PBNZ理化性质表征
如图9所示,与POD长时程催化结果类似,在经历24小时CAT类酶催化反应后,回收的PBNZ催化活性增强,H2O2对PBNZ的氧化作用提升了表面Fe3+含量、增加了颗粒表面粗糙程度进而增强了其CAT类酶活性。
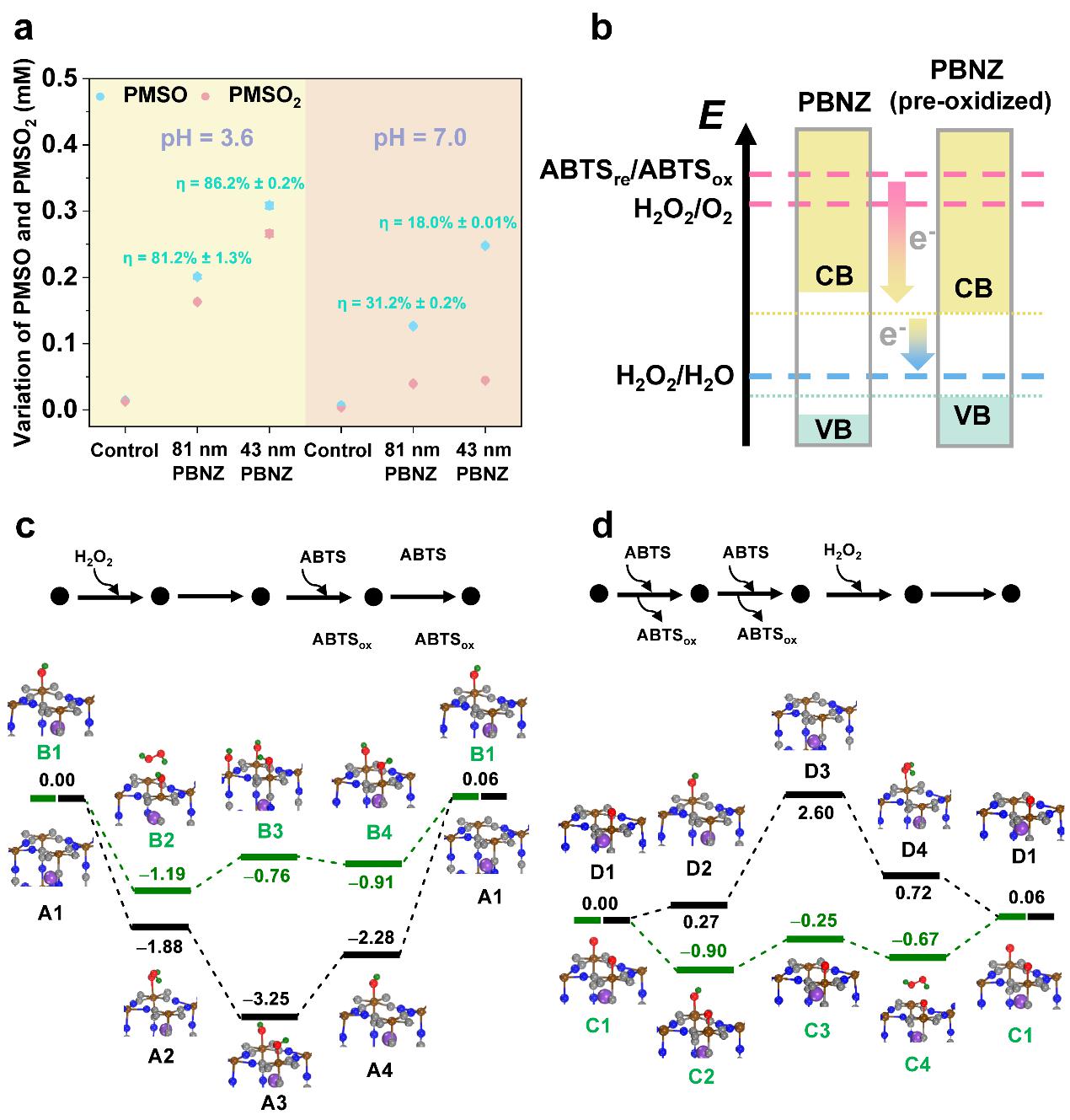
图10 PBNZ催化机制研究
如图10所示,实验表明Fe-O、Fe-OH结构在PBNZ催化过程中发挥重要作用。H2O2的不可逆预氧化使得PBNZ光学带隙窄化、对氧原子/羟基的吸附能力适中,进而促进了基于导/价带机制的电子转移双路径,最终提升了PBNZ的类酶活性。
该研究验证了PBNZ较强的催化可持续性并发现了PBNZ“催化自增强”的特性。实验和理论计算共同表明,PBNZ类酶催化过程中的电子转移由导/价带双路径介导,且其表面的不可逆预氧化对电子转移具有较大的促进作用。该工作以“Elucidating the catalytic mechanism of Prussian Blue nanozymes with self-increasing catalytic activity”为题发表在Nat Commun(2024)[6],东南大学生物科学与医学工程学院博士生封开政为本论文的第一作者,东南大学张宇教授、马明教授和国家纳米科学中心高兴发教授为论文的共同通讯作者。
这项研究的创新之处在于首次揭示了PBNZ自增催化活性的机制,这一发现不仅为理解纳米酶的催化行为提供了新的视角,也为设计更高效、更稳定的纳米酶材料提供了理论基础。此外,PBNZ的长服务寿命特性使其在实际应用中具有更高的可靠性和持久性,这对于推动纳米酶技术在生物医学和环境治理等领域的应用具有重要的实践意义。总之,这项研究为纳米酶领域的发展开辟了新的道路,有望引领未来纳米技术的新潮流。
尽管实验表征和理论计算使得纳米酶催化机制不断明晰,机制研究中仍面临诸多挑战,如:催化活性中间体种类与状态鉴别、相邻催化位点的相互作用研究、理论计算模型与实际催化结构及过程存在偏差等。在后续研究中,只有将实验与理论计算进一步结合并不断探索,才能得到更加细致、综合的纳米酶催化机制,最终为其理性设计与应用奠定坚实基础。
论文信息:
[1] ACS Nano 2012, 6, 4001-4012.
[2] Nat. Commun. 2022, 13: 5365.
[3] ACS Nano 2023, 17, 24170-24186.
[4] J. Am. Chem. Soc. 2016, 138, 5860-5865.
[5] ACS Nano 2023, 17, 15, 14555–14571
[6] Nat. Commun. 2024, 15: 5908.