背景介绍
一直以来,微生物感染对全球人类健康持续构成严重威胁,抗生素是目前应用最广的抗菌方法。然而,抗生素过度使用导致了微生物耐药性增加,迫切需要开发新型抗菌疗法。研究表明,纳米材料具有抑菌、杀菌性能。然而,许多抗菌纳米材料存在水溶性差、生物相容性不足等缺点,且大多数纳米材料缺乏抗真菌活性。因此,迫切需要开发具有广谱抗菌特性和良好生物相容性的纳米材料,来解决上述问题。
碳点(Carbon dots, CDs)作为一种新型的零维碳基荧光纳米材料,因其突出的特性而受到越来越多的关注,成为近年来的研究热点。相较于其它纳米材料,CDs易于合成,具有高水分散性、低毒性、良好的生物相容性和优异的光致发光性能。由于表面包含氨基(-NH₂)、羟基(-OH)和羧基(-COOH)等不同种类的官能团,CDs表现出不同的电性。研究表明,带正电荷的CDs可以通过静电相互作用很容易地与带负电荷的细菌细胞膜结合并相互作用,通过损伤细胞膜杀死细菌。
真菌是天然抗菌化合物的重要来源,然而直接从真菌中提取的抗菌化合物具有毒性高、稳定性有限、难以长时间存储等缺点。真菌来源的纳米材料的开发可以解决上述难题。与其它材料相比,纳米材料由于其尺寸、形状、电荷、稳定性和表面积而具有独特的性质,这使得纳米材料能更快地穿透致病细菌,干扰细胞内容物,从而导致细菌死亡。利用真菌提取物制备抗菌CDs尚未见报道。
鉴于此,东南大学林凤鸣教授团队开发了相较于真菌天然提取物具有更好的杀菌效果和伤口愈合能力、良好生物安全性的碳点,有望作为新型抗菌药物(图1)。本研究利用真菌提取物制备高效抗菌荧光碳点,为从天然产物中开发新型抗菌纳米材料提供了一种新的灵活策略,并规避了在从天然产物发现和开发抗菌药物过程中遇到的毒性高、稳定性有限、难以长时间存储以及抗菌性能一般等缺点。
相关成果以“Carbon-dots-mediated improvement of antimicrobial activity of natural products”为题,发表在期刊ACS Applied Materials & Interfaces上。论文第一作者为东南大学生物科学与医学工程学院博士后Babar Khan,通讯作者为东南大学林凤鸣教授。
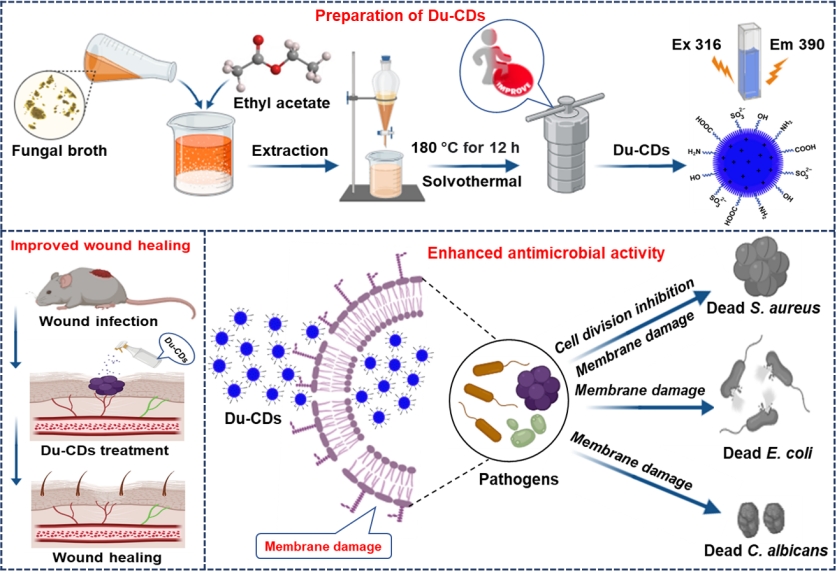
图1. Du-CDs的合成及其抗菌应用示意图
图文导览
以对间座壳菌YSP3培养液的乙酸提取物为原料,通过溶剂合成法,制备了量子产率为6.2%,具有蓝色荧光的Du-CDs,如图2所示。透射电镜观察的结果显示该荧光碳点呈石墨或非晶体状,平均粒径约为13.9 nm,如图2A所示。Du-CDs的紫外可见吸收光谱在280 nm左右有一个条带(图2B),这是由于C=C和(或)C=O键引起的π˗π*转变。通过Zeta电位分析确定Du-CDs的表面电荷为9.2±0.6 mV(图2C),这表明Du-CDs带正电荷。Du-CDs在激发波长为316nm时,在390 nm处有最大发射(图2D)。FTIR(图2E)光谱分析显示Du-CDs中存在N-H,O-H,C-H,C=O和C-N键。Du-CDs的XPS光谱(图2F-2J)显示了Du-CDs中元素的组成以及官能团构成。
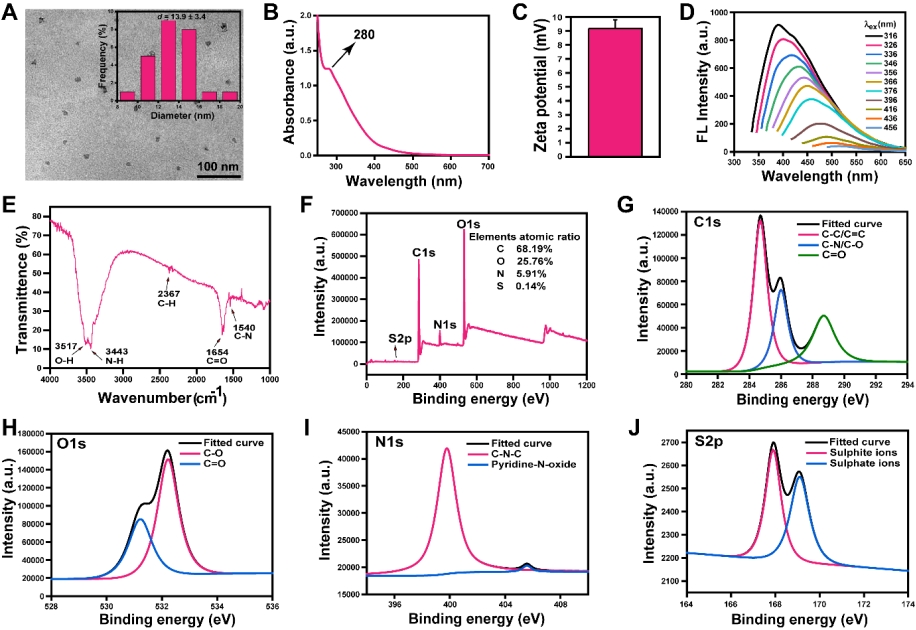
图2. Du-CDs的结构表征
为了评估Du-CDs的抗菌效果,作者分别以金黄色葡萄球菌、大肠杆菌和白色念珠菌作为革兰氏阳性菌、革兰氏阴性菌和真菌的模式菌株,用50µg/mL的原料(真菌提取物)或Du-CDs分别处理微生物细胞,比较其抗菌活性,如图3A所示,Du-CDs比原料显示出明显增强的抗菌活性。这表明以天然产物提取物为原料合成形成CDs,是提高天然产物提取物的抗菌活性的有力手段。
随后,用不同浓度的Du-CDs处理三种模型菌株,测量OD600,如图3B-3C所示,得到Du-CDs对金黄色葡萄球菌、大肠杆菌和白色念珠菌的MIC分别为3、3和18 μg/mL。为了进一步验证Du-CDs的抗菌能力,作者采用平板计数法评估Du-CDs处理后微生物菌株的活力(图3E-3J),分别在50、100和100 μg/mL Du-CDs时未观察到金黄色葡萄球菌、大肠杆菌和白色念珠菌的菌落。
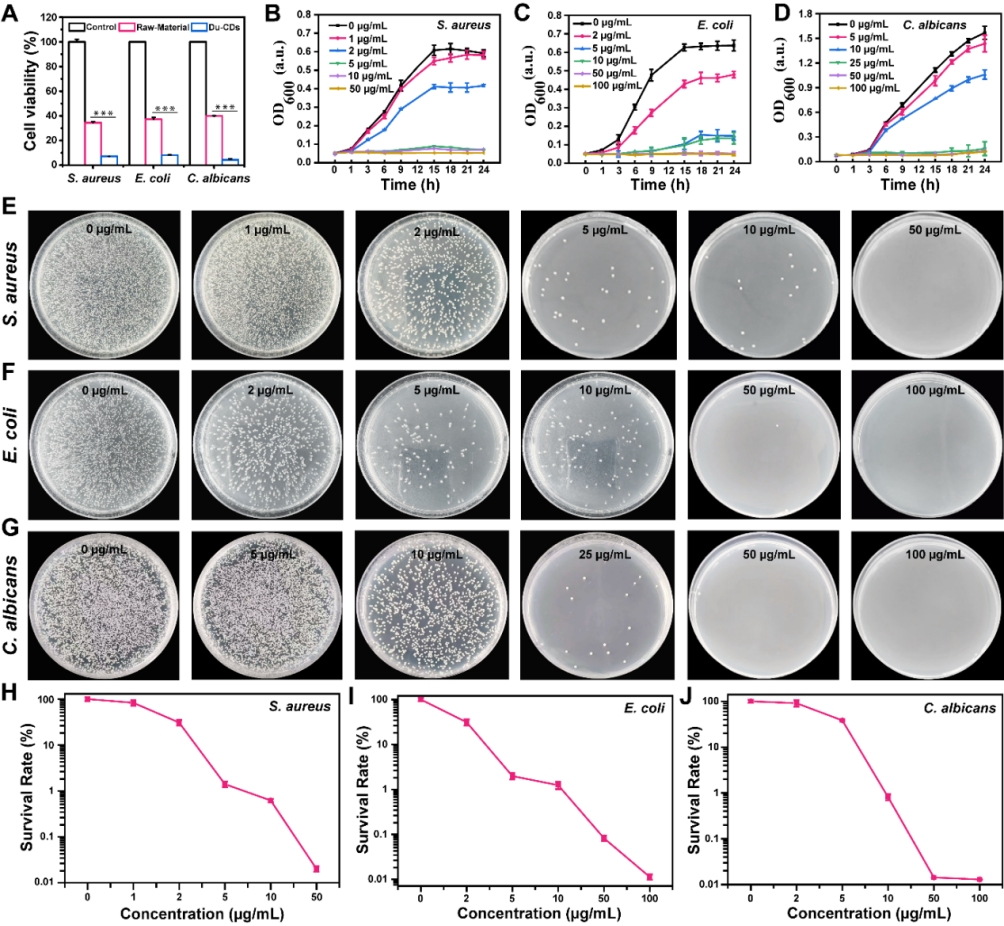
图3. Du-CDs的体外抗菌评价
为了分析Du-CDs与细胞作用的原理,作者用荧光共聚焦显微镜追踪观察了Du-CDs处理的三种模式微生物细胞,发现细菌真菌细胞中存在大量蓝色荧光(图4A),这表明Du-CDs可以进入细胞。随后作者将金黄色葡萄球菌、大肠杆菌和 白念珠菌分别与Du-CDs在去离子水、细胞PBS、10 %氯化钠和5 % SDS中共孵育,如图4B所示,10 %的氯化钠中孵育的金黄色葡萄球菌和白色念珠菌细胞的荧光强度显著降低,表明了Du-CDs通过静电相互作用与这两种细胞结合;5 % SDS中孵育的大肠杆菌细胞的荧光强度显著降低,而10 %的氯化钠中孵育的大肠杆菌荧光强度并没有显著降低,表明了Du-CDs通过疏水相互作用与大肠杆菌细胞结合。
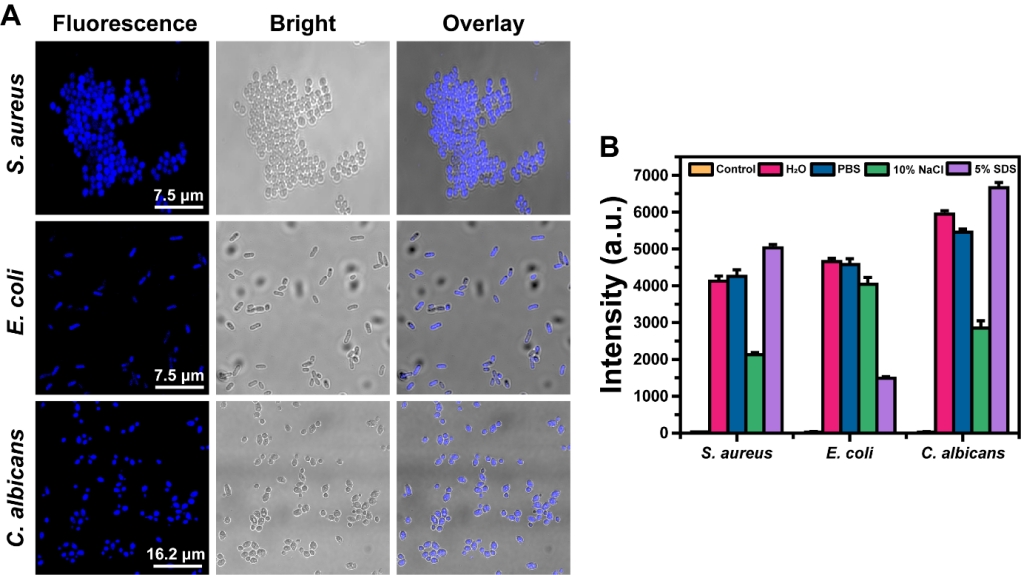
图4. Du-CDs在细胞中的分布和与细胞的相互作用分析
随后,为了深入了解Du-CDs的抗菌机制,作者利用扫描电镜(SEM)和碘化丙啶(PI)染色对Du-CDs处理的微生物细胞的形态和膜完整性进行了表征(图5)。Du-CDs处理的金黄色葡萄球菌细胞表面可以观察到Du-CDs的附着(图5A)且其表面与未经处理的细胞相比出现了更多的分裂间隔(图5B),这表明金黄色葡萄球菌的细胞分裂可能被Du-CDs中断。进一步分析与细胞分裂相关的基因的表达时,我们可以观察到编码细胞分裂蛋白FtsZ、FtsL、FtsW和FtsQ的基因表达增高(图5C),这可能是Du-CDs杀微生物作用的一种补偿机制。Du-CDs处理的金黄色葡萄球菌细胞表面未观察到明显的细胞膜损伤,而Du-CDs处理的大肠杆菌和白色念珠菌的细胞表面均表现出异常皱起且细胞表面周围出现裂隙,表面其细胞膜完整性受损(图5A)。由此可见,Du-CDs抗菌作用的分子机制在不同的微生物中可能是不同的。红色荧光的PI只能穿透细胞膜受损的微生物细胞,而不能穿透细胞膜完整的微生物细胞,利用碘化丙啶(PI)对Du-CDs处理前后的微生物细胞进行染色(图5D),进一步验证了上述分析。
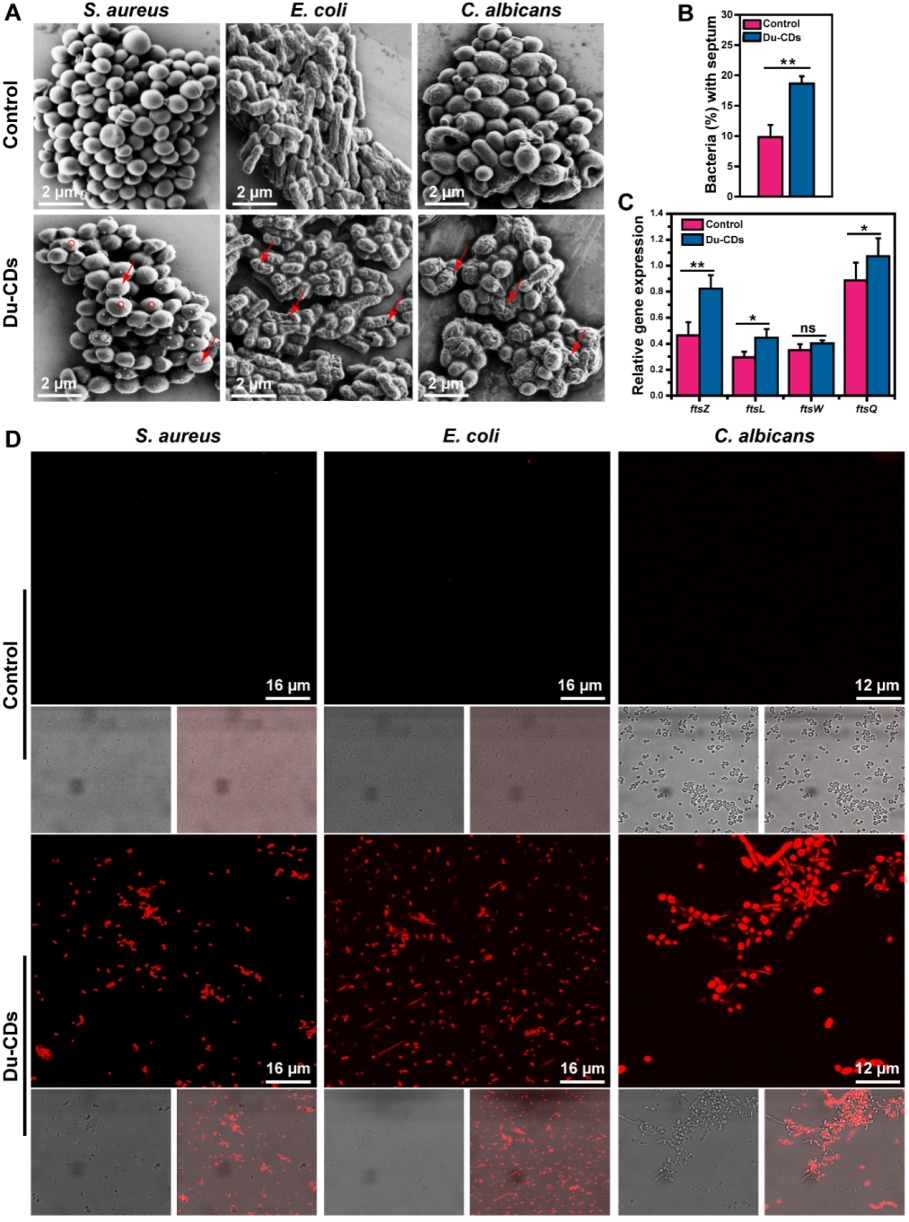
图5. Du-CDs的抗菌机理
作者随后探究了Du-CDs的体内抗菌效果与生物安全性。分别用PBS与Du-CDs处理创口直径为10 mm的金黄色葡萄球菌感染的全层创面小鼠(图6A),3天后Du-CDs组相较于PBS组的创面面积缩小量明显更高(图6B-6C),Du-CDs组与PBS组小鼠的伤口分别在18天和第21天完全愈合,愈合过程中Du-CDs处理的小鼠创面中残留的金黄色葡萄球菌数量显著小于PBS处理的小鼠创面(图6D-6E)。这表明Du-CDs可以显著促进皮肤伤口愈合,具有良好的体内抗菌活性。实验过程中所有被测小鼠体重均逐渐增加,Du-CDs组与PBS组间无显著差异,这宏观上说明了Du-CDs具有良好的的生物安全性。为了评估了Du-CDs对红细胞的溶血毒性(图6G),作者用浓度为15 µg/mL的Du-CDs孵育新鲜红细胞1 h,只有13.14%的红细胞被裂解,这表明Du-CDs具有良好的血相容性。收集PBS或Du-CDs治疗后的小鼠的主要器官(心、肝、脾、肺和肾脏)并对其进行苏木精和伊红(H&E)染色,观察到与PBS组小鼠相比,经Du-cd处理的小鼠组织保持不变(图6H),这显示了Du-CDs的良好生物安全性。利用Masson三色染色显示这些器官组织中胶原纤维的组织状态,Du-CDs处理的小鼠与PBS的处理的小鼠组织中无明显的胶原蛋白差异,进一步证明了Du-CDs具有良好的生物相容性。
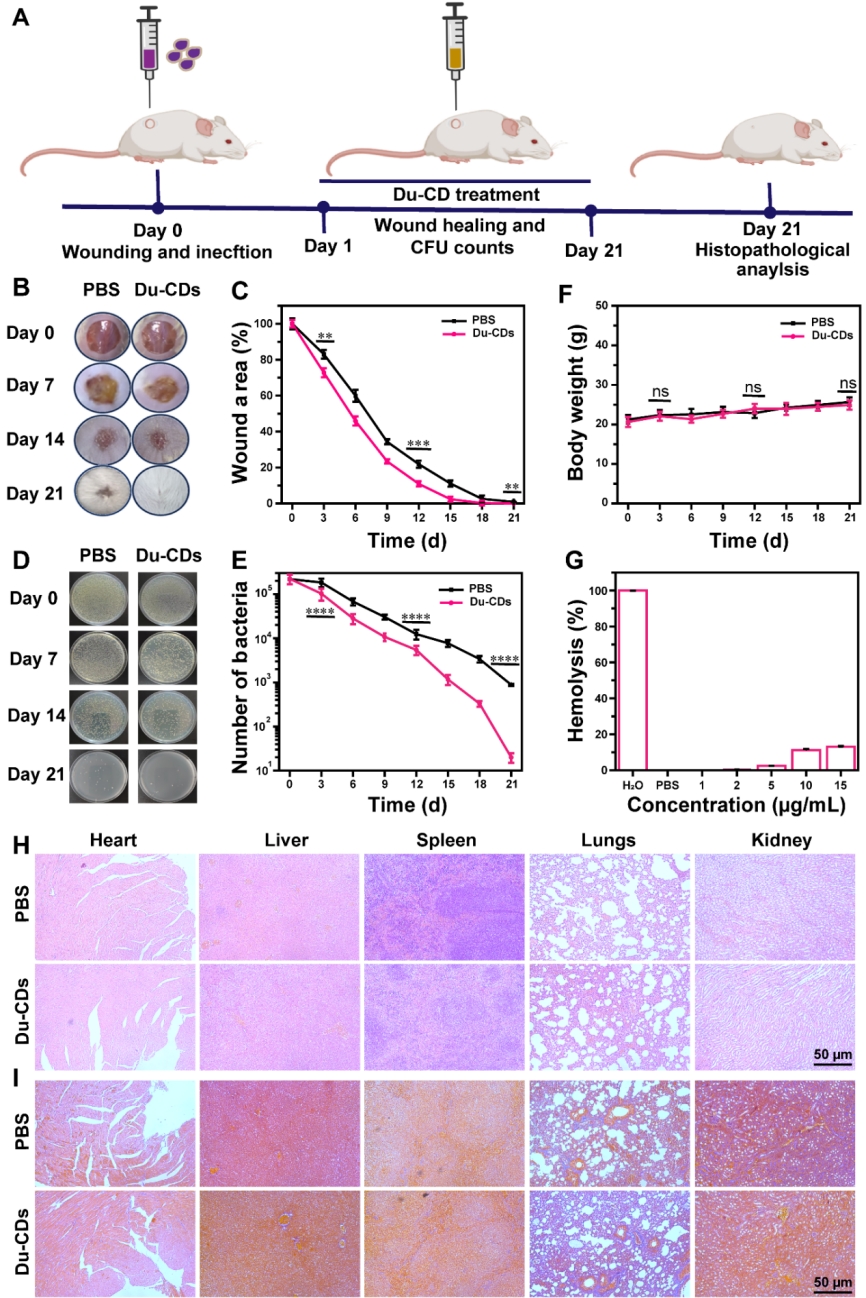
图6. Du-CDs对金黄色葡萄球菌感染小鼠模型的体内伤口愈合和抗菌性能评价
总结与展望
本研究以内生真菌YSP3的天然产物为原料,制备了功能碳点Du-CDs,整个合成过程简单、快速、经济有效、环保友好。Du-CDs在水溶液中分布均匀,平均直径为13.9 nm,并带正电荷,发出蓝色荧光。与真菌提取物相比,Du-CDs对细菌和真菌的抗菌效果都有所改善,这可能是因为CDs可以与微生物细胞表面通过电子相互作用或疏水相互作用进行相聚作用,大量进入微生物细胞,并分布在整个细胞,从而增加细胞内抗菌化合物的浓度。Du-CDs的抗菌机制是菌株依赖的,在金黄色葡萄球菌、大肠杆菌和白色念珠菌中均可通过诱导细胞膜完整性受损实现抑菌作用,而仅在金黄色葡萄球菌中抑制细胞分裂从而实现抑菌效果。此外,Du-CDs还表现出了良好的体内抗菌作用和加速伤口愈合能力,具有良好的生物相容性。总之,本研究为从天然产物中开发新型抗菌纳米材料提供了一种新的灵活策略,规避了从天然产物中发现和开发抗菌药物过程中遇到的缺点。
文献链接:https://pubs.acs.org/doi/10.1021/acsami.4c09689