增强的通透性和滞留(EPR)效应是实体瘤实现被动靶向的关键,但由于EPR效应的异质性,许多纳米药物未能取得较好的临床疗效。因此,了解EPR效应的机制对于克服纳米药物在临床转化中面临的障碍至关重要。为了解决这个问题,重点实验室张宇教授、武昊安副研究员团队和涂景教授团队学科交叉合作,结合“影像学”和“基因组学”的方法,通过基因通路富集分析,提高了对纳米粒子(NPs)进入肿瘤的关键影响因素的认识。

图1. 期刊论文
本工作使用聚乳酸-羟基乙酸共聚物(PLGA)包覆的Fe3O4NPs作为对比剂,通过磁共振成像技术(MRI)观察和定量分析NPs的单层和多层分布。更重要的是,利用多维度和多尺度分析充分挖掘这些MRI数据的空间特征,并对MRI数据进行精确分组,提高了MRI评估血管通透性的准确性。通过执行基因本体(Gene Ontology, GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)富集分析,我们鉴定了影响血管通透性的多种基因,如Cldn1、Dlg2、Bves、Prkag3、Cldn10和Cldn8,这些基因与紧密连接有关,控制肿瘤血管的通透性(图2)。具体研究成果发表在ACS Nano上,题为:Magnetic resonance imaging-based radiogenomic analysis reveals genomic determinants for nanoparticle delivery into tumors(https://doi.org/10.1021/acsnano.4c09387)
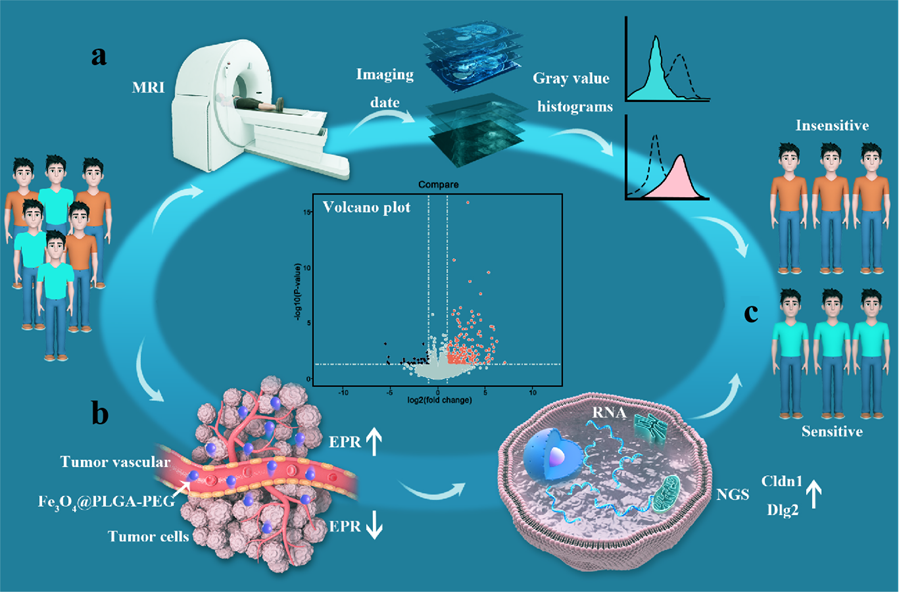
图2. 影像转录组学用于评估EPR效应的示意图。
具体研究内容
(1)肿瘤时期筛选:
为更准确的评估MRI的EPR效果,在MRI数据采集前,需要筛选合适肿瘤分期的小鼠。选择了四个时期不同大小的肿瘤进行磁共振成像实验,并进一步通过计算机辅助计算的方法评估了不同时期纳米探针的累积情况,从而选择肿瘤时期(图3,表一)。
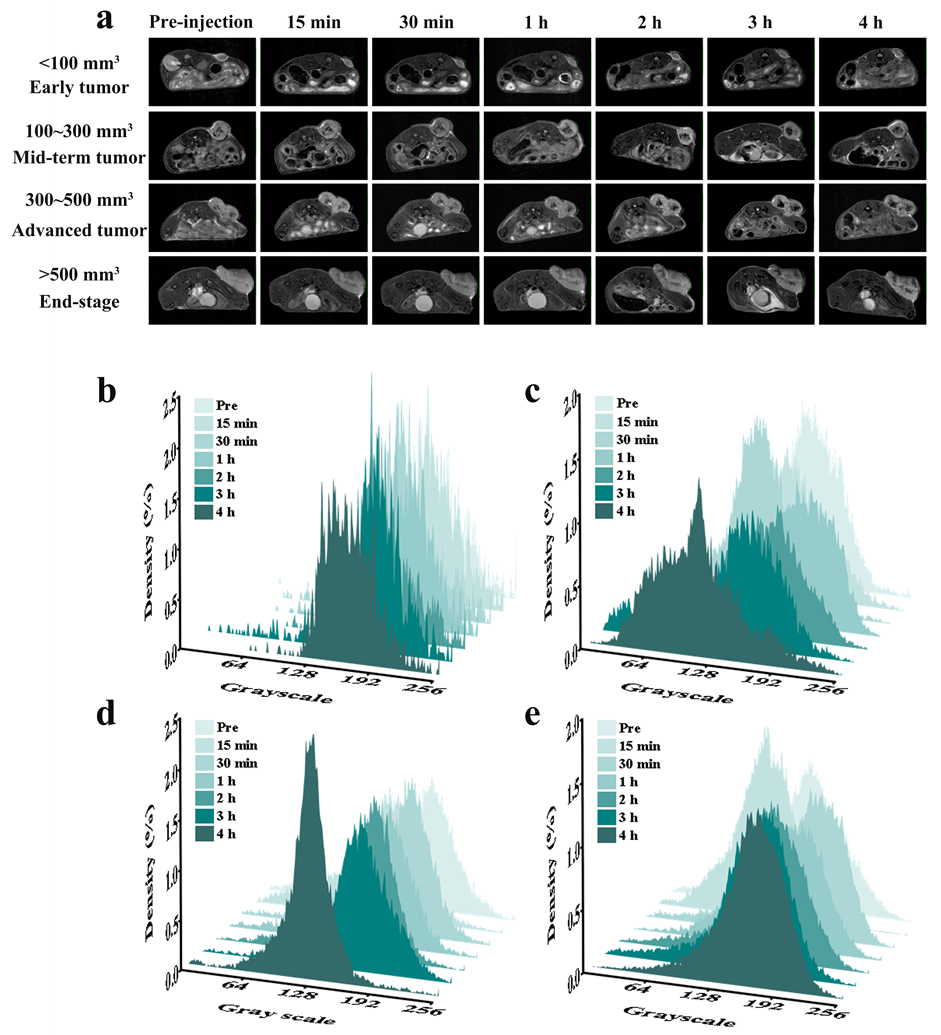
图3.(a)荷瘤小鼠T2加权磁共振图像(肿瘤在不同阶段进行评估:早期肿瘤,<100 mm³;中期肿瘤,100-300 mm³;晚期肿瘤,300-500 mm³;和终末期肿瘤,>500 mm³)在给予Fe3O4@PLGA-PEG纳米颗粒之前以及之后的15分钟、30分钟、1小时、2小时、3小时和4小时。不同时间点不同阶段肿瘤的MRI灰度值直方图,通过线性变换归一化(横坐标:灰度值;纵坐标:灰度值百分比):(b)早期肿瘤,(c)中期肿瘤,(d)晚期肿瘤,以及(e)终末期肿瘤。
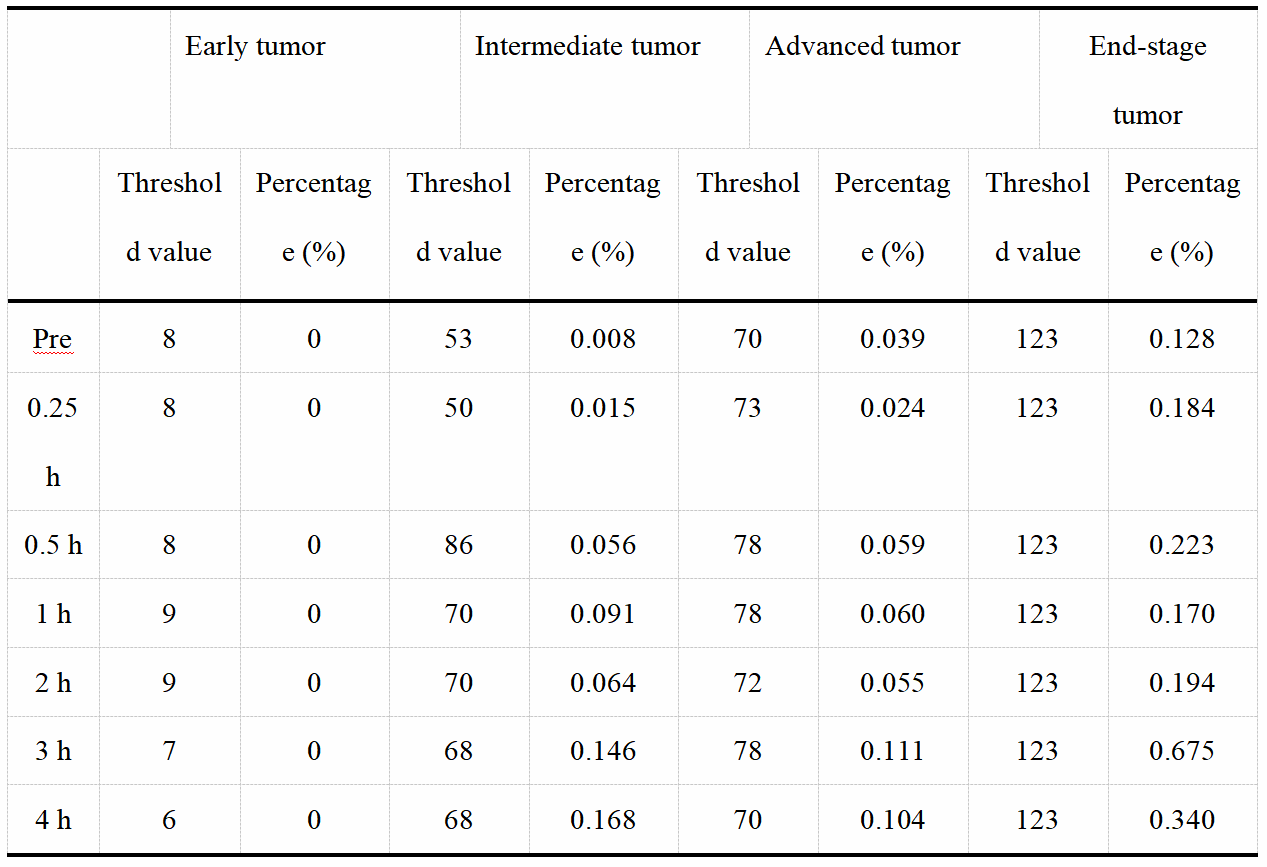
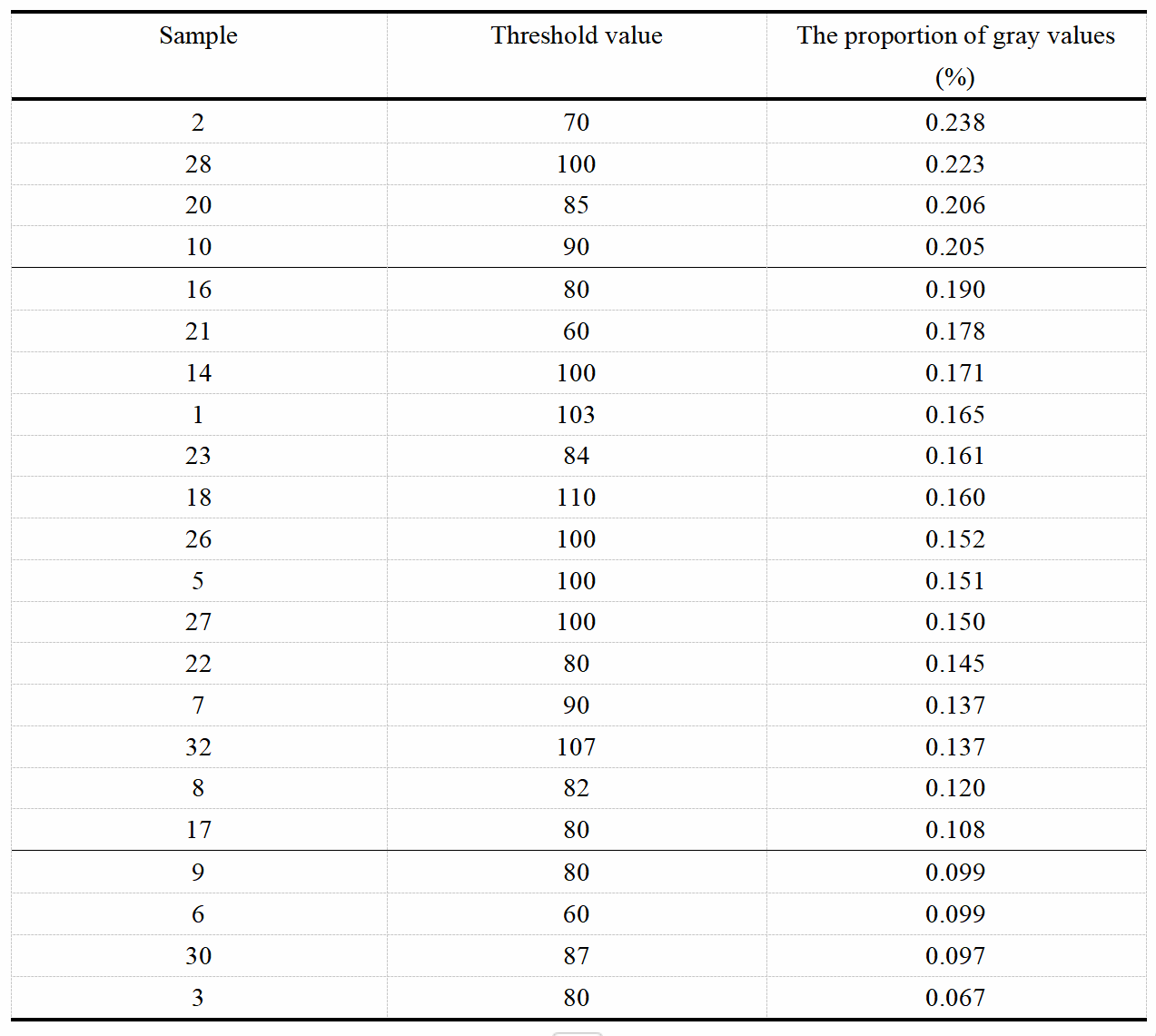
表一:采用大津法计算不同阶段肿瘤样本的阈值,并计算小于阈值的灰度值所占比例。
(2)造影后乳腺癌MRI数据分析:
根据筛选结果,构建32只乳腺癌小鼠皮下瘤模型,待肿瘤大小达到300-500 mm3之间,注射前及尾静脉注射Fe3O4@PLGA-PEG纳米探针3 h后均需进行MRI扫描(图4)。通过AnatomySketch v2.0软件进行感兴趣区域选择,并进行了MRI数据灰度值直方图分析,大津法计算出阈值后,结合灰度值直方图计算出小于阈值的灰度值所占的比例(图5,表二)。小于阈值的灰度值的比例不同,比例越大,说明暗图像所占比例越大,即纳米探针累积越多,MRI成像效果越好,说明肿瘤血管通透性较高,EPR效应较好。最终对样本进行分组排序,Ⅰ组包括样本m2、m28、m20、m10号小鼠,成像效果好;Ⅲ组 为m9、m6、m30、m3号小鼠样本,成像效果较差;剩余其他为Ⅱ组,成像效果一般。
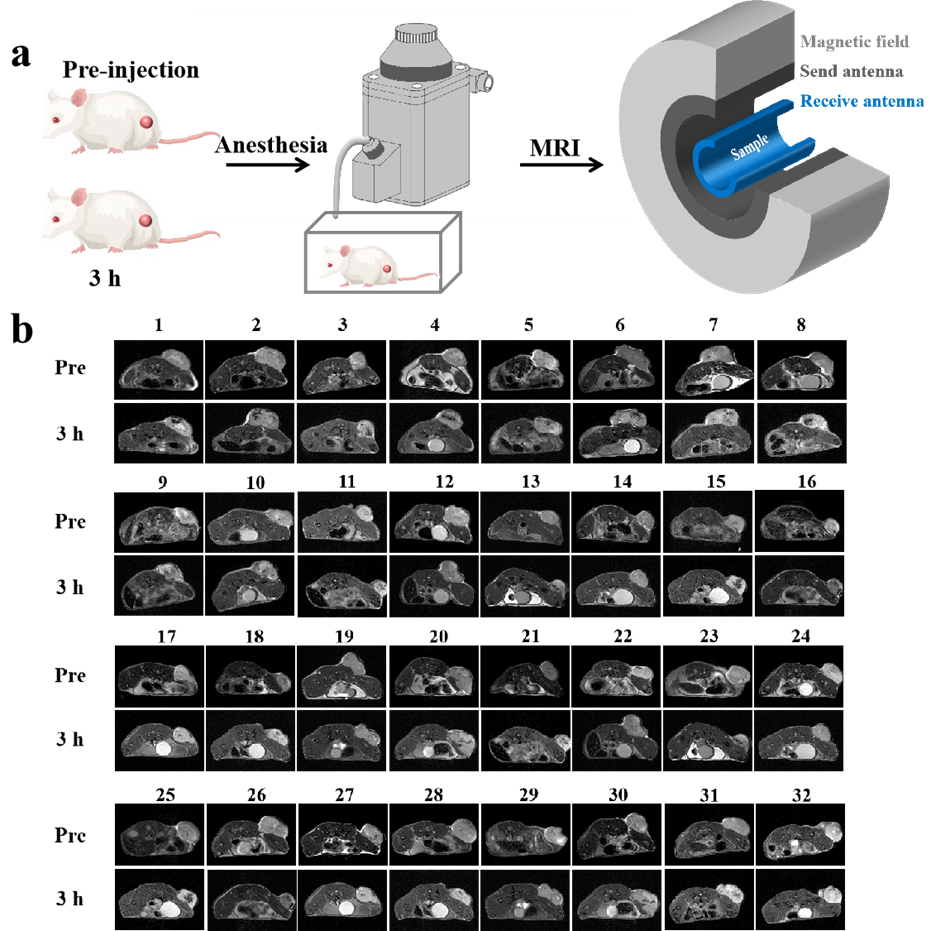
图4.荷瘤小鼠体内磁共振成像。(a)荷瘤小鼠MRI过程示意图。将麻醉的小鼠固定在小鼠线圈中,使用7T MRI仪获取图像。(b)注射Fe3O4@PLGA-PEG纳米粒子前及注射后指定时间点的荷瘤小鼠T2加权MRI图像。
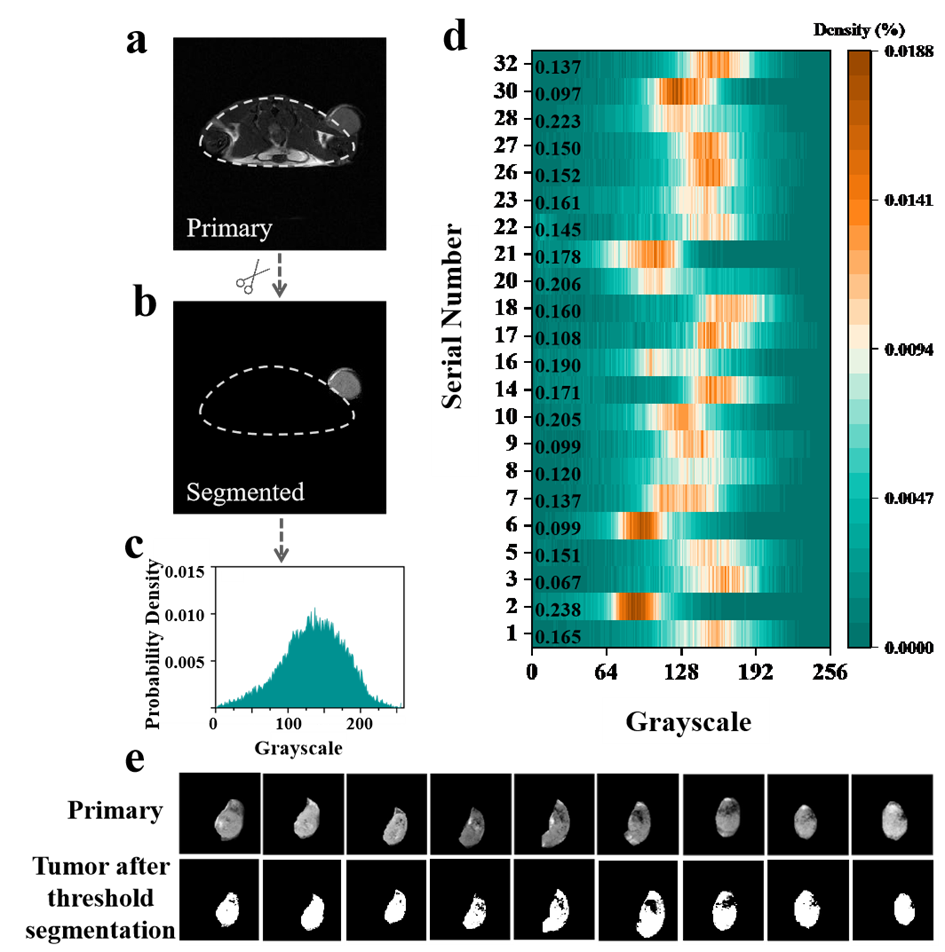
图5. (a)荷瘤小鼠的T2加权MRI图像(样本8)。(b)使用Anatomy Sketch v2.0软件对肿瘤的T2加权MR图像进行分割(样本8)。(c)肿瘤的标准化直方图(样本8)。(d)不同肿瘤样本(样本1、2、3、5、6、7、8、9、10、14、16、17、18、20、21、22、23、26、27、28、30、32)的标准化直方图。从绿色到黄色的过渡表示密度从小到大。(e)使用大津法进行阈值分割前后的肿瘤MR图像。
表二不同样本的MRI阈值及灰度值小于阈值的比例。
(3)基于RNA-seq分析的机制研究:
根据磁共振结果以及RNA质量检测结果将小鼠分为两组。共检测到19108个基因,使用DESeq2在两组间鉴定出244个差异表达基因(DEGs)。其中,217个基因表达上调,27个基因表达下调。此外,进行了GO富集分析,DEGs在2479个GO项中富集,其中240个在86个DEGs中显著富集。同时,作者绘制了KEGG中与经典通路相关的DEGs以识别与组I相关的通路(图6)。最终发现,I组相关基因(Cldn1、Dlg2、Bves、Prkag3、Cldn10、Cldn8)表达水平显著低于II组,并进行了验证。
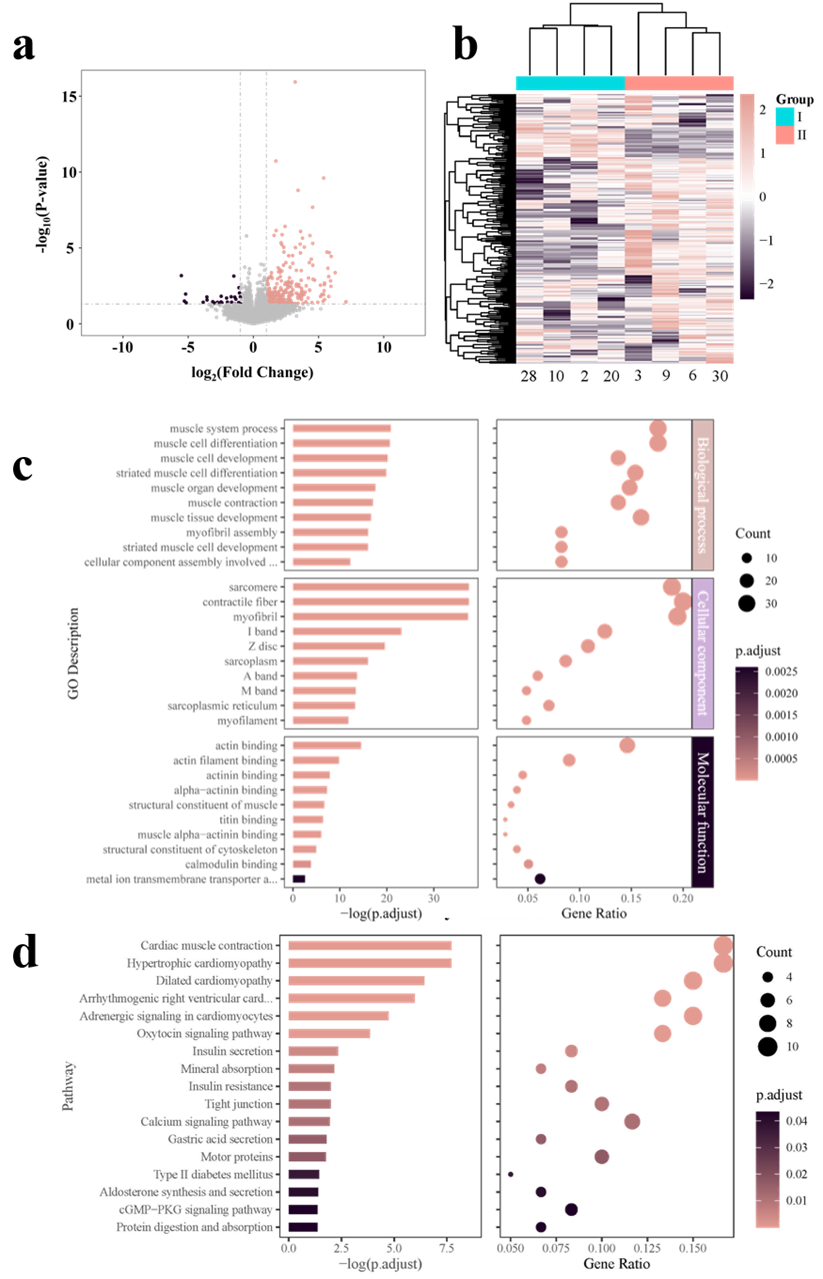
图6.I组和II组的转录组学分析。(a) DESeq2 DEGs的火山分布图。粉色和深红色点对应两组的2倍变化。(b)I组(对照组)和II组(试验组)的DEGs热图。样本名称列示,显著差异表达基因列示。基因根据其表达的相似性聚类在一起。颜色表示Z值从高(粉色)到低(深红色)。(c) DEGs的基因功能在240个GO项中富集(FDR校正p < 0.05);这里只显示每个域的前10个类别。从上到下是三个GO结构域(粉色为生物过程,紫色为细胞成分,深紫色为分子功能)。对于左侧面板中的条形图,较长的条形图表示较小的调整后p值,而右侧面板中的较大气泡表示存在更多DEGs。(d) KEGG通路中DEG的富集。左侧面板中较长的条表示调整后的p较小,而右侧面板中较大的气泡表示存在更多DEGs。
总结和展望
本研究提出了一种新的更有效的方法处理MRI图像,并结合二代测序技术,通过影像基因组学分析影响MRI结果的通路、基因。确定了可能影响紧密连接并改变血管通透性的通路和基因,从而调节EPR效应。总之,该研究探索了EPR效应的异质性,以便在纳米药物治疗前对患者进行分层。但是本研究仍具有局限性,首先,研究使用的动物模型相对较小,可以构建其他大型动物模型进行研究;其次,可采用其他类型肿瘤模型进行实验方法验证,如淋巴瘤;此外,影响EPR效应的因素不仅限于血管,还可能包括其他因素,如淋巴回流等;另外,增加样本量,通过机器学习提高数据处理的准确