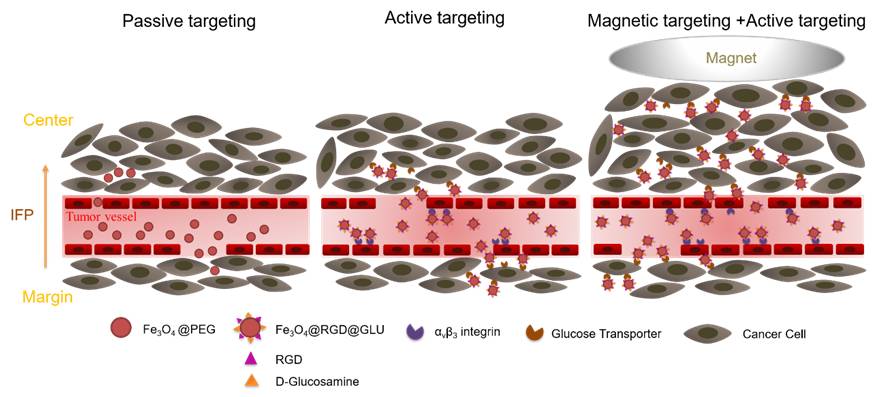
基于氧化铁纳米颗粒的磁感应热疗已被用于临床复发性胶质瘤的辅助治疗,但是这种治疗仅局限于瘤内注射,经静脉注射的肿瘤靶向磁感应热疗仍然面临大的挑战。为了达到肿瘤的治疗温度,氧化铁纳米颗粒需要产生足够的热量:首先,要有足够数量的纳米颗粒聚集到靶向部位;其次,要在安全的交变磁场下进行热疗。依赖于肿瘤EPR效应的被动靶向是目前体内药物递送的主要方式,但是由于EPR效应的异质性,纳米治疗剂在瘤内的分布差异巨大,且瘤内的累积量有限。双靶向纳米探针的构建在被动靶向基础上,可以进一步的增加成像的敏感性,且在肿瘤内具有更强的渗透能力。磁靶向是另一种有效的靶向策略,可以诱导血管内的磁性颗粒靶向到疾病部位。
为此,我们构建了一种具有广谱性的双特异磁性纳米探针,并采用主动靶向和磁靶向联合的靶向策略,从而实现有效的肿瘤磁共振成像和磁感应热疗。这种带有双配体的氧化铁纳米探针(Fe3O4@RGD@GLU)可以同时靶向到肿瘤血管内皮特异性表达的αvβ3整合素和肿瘤细胞表面高表达的葡萄糖转运蛋白。我们比较了三种不同靶向策略下的肿瘤磁共振对比成像效果和肿瘤磁热治疗效果,分别是被动靶向、主动靶向、主动靶向联合磁靶向,成像和抑瘤效果一致显示主动靶向结合磁靶向的联合靶向策略获得了最佳的肿瘤成像和治疗效果。体内生物分布实验也证实,联合靶向策略下,肿瘤组织内的氧化铁纳米颗粒的累积量达到最大。并且,在磁力作用下纳米探针可以渗透到肿瘤组织的深部,促进肿瘤热疗效果。这种双靶向的纳米探针有望作为对比剂和治疗剂用于静脉注射,实现联合靶向模式下的肿瘤磁共振成像和磁感应热疗。
文章已在ActaBiomaterialia发表:
https://doi.org/10.1016/j.actbio.2019.07.017。