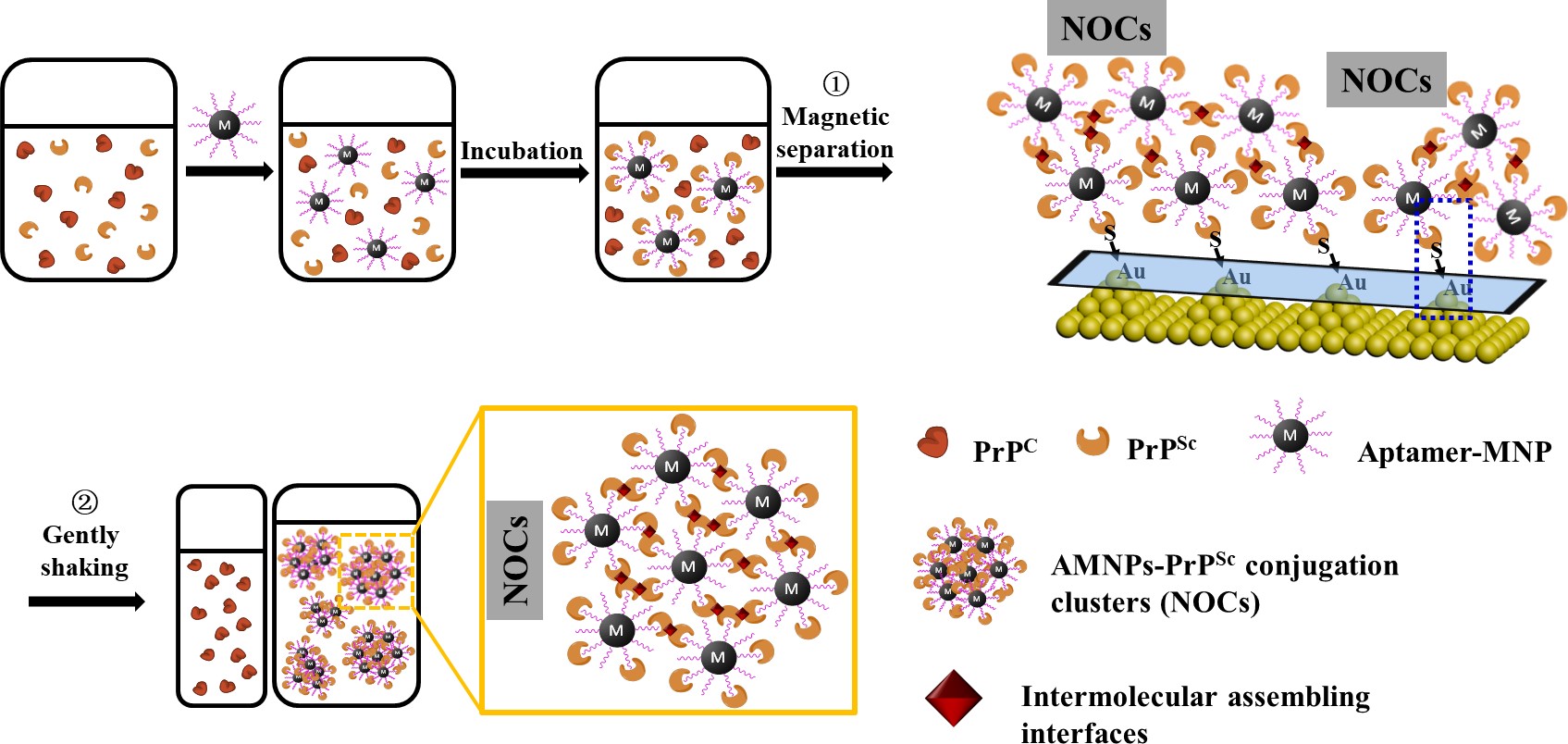
朊蛋白(Prion Protein)是一种细胞表面蛋白。该蛋白分子量较小(23 kDa),具有两种不同的构象,分别称为PrPSc和PrPC,这两种构象的蛋白氨基酸序列相同,却具有不同的空间构象。而PrPC向PrPSc构象的转化,被认为是神经退行性海绵状脑病(TSE)等朊蛋白类疾病的致病和传播原因。目前,PrPSc已经被作为朊蛋白类疾病早期诊断的生物标志物加以研究,有报道显示,其在仓鼠体内的最小致死剂量仅为2 nM。基于此,对于生物体内微量的PrPSc分子定性和定量检测对于疾病诊断和治疗监测至关重要。然而,包括蛋白质错误折叠循环扩增法(PMCA)和酶联免疫吸附测定(ELISA)等方法在内的常用医疗免疫监测手段,均需要大量的时间和人力消耗,且难以避免生物样品中存在的PrPC的干扰,故存在明显的局限性而不适合该类小分子蛋白的高通量、高灵敏度监测。
基于以上考虑,我们构建一种新型的“三明治”式表面等离激元(SPR)生物传感器监测体系,利用PrPSc独特的自组装特性,将标记了智能磁性探针的PrPSc在外加静磁场定向富集过程中组装成为纳米颗粒-生物分子团簇(nanoparticle-organic clusters, NOCs),再通过SPR进行检测。结果显示,经过处理样品的SPR检测信号达到原始信号的215倍,而传统的“三明治”检测体系只能达到原始信号的65倍。该系统针对PrPSc的最低检测限为1E-4 ng/mL,远低于其他检测手段,同时其定量检测的浓度范围也远大于其他检测手段,为1E-4 ~ 1E5 ng/mL。另外,实验结果还证实,该检测体系具有很高的特异性和实际生物样品检测能力,检测结果受到样品中同时存在的其他生物小分子、蛋白(如BSA、PrPC等)的影响较小。该方法有望通过改变磁性颗粒表面修饰的特异性适体分子,构建针对其他具有类似结构的生物分子的高特异性和高灵敏度的检测体系。
本工作已经整理成相关研究论文,在Analytical Chemistry上在线:http://pubs.acs.org/doi/10.1021/acs.analchem.7b03768。