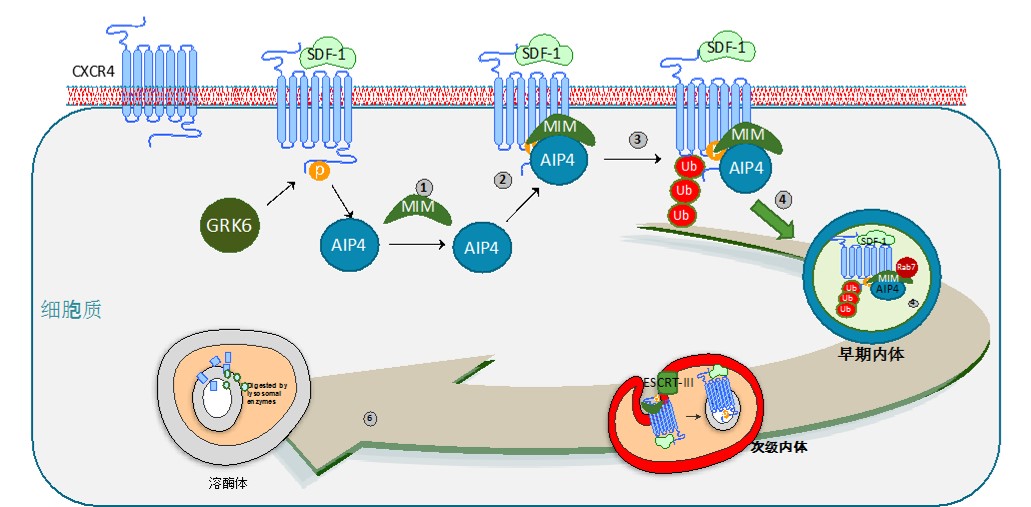
“MIM蛋白是参与细胞膜结构变化以及多种生理、病理过程的膜蛋白,它在多种肿瘤细胞中具有异常的表达。MIM可以下调细胞膜表面的CXCR4数量,然而其机理尚属未知。本文发现,在SDF-1的刺激下,MIM蛋白通过结合E3泛素连接酶AIP4而和CXCR4形成复合物,进而上调了CXCR4的泛素化水平以及降解效率,最终降低了细胞表面的CXCR4数量、抑制了细胞对于SDF-1的应激反应。另一方面,在向溶酶体转运的过程中,MIM蛋白的高表达促进了次级转运小体(多囊泡体MVB)的成熟,而这种现象建立在MIM和GTP酶Rab5、Rab7相互作用的机制之上。在细胞受到刺激后的5分钟、30分钟,MIM蛋白分别和Rab5、Rab7具有明显的相互作用,这说明,MIM/CXCR4在初级内体(EEA)以及次级内体(MVB)中实现了转运。本文进一步发现MIM和Rab7之间的相互作用有赖于MIM蛋白N-端的卷曲螺旋基团(coiled-coil motif)。本文的工作揭示了MIM蛋白的新功能,它将蛋白质的泛素化和Rab酶介导的受体胞内转运结合起来。对于理解细胞的胞吞作用,胞内转运以及蛋白质降解具有重要意义。”
这项工作已经发表在细胞生物学杂志Journal of cell science上http://jcs.biologists.org/content/early/2017/03/03/jcs.198937