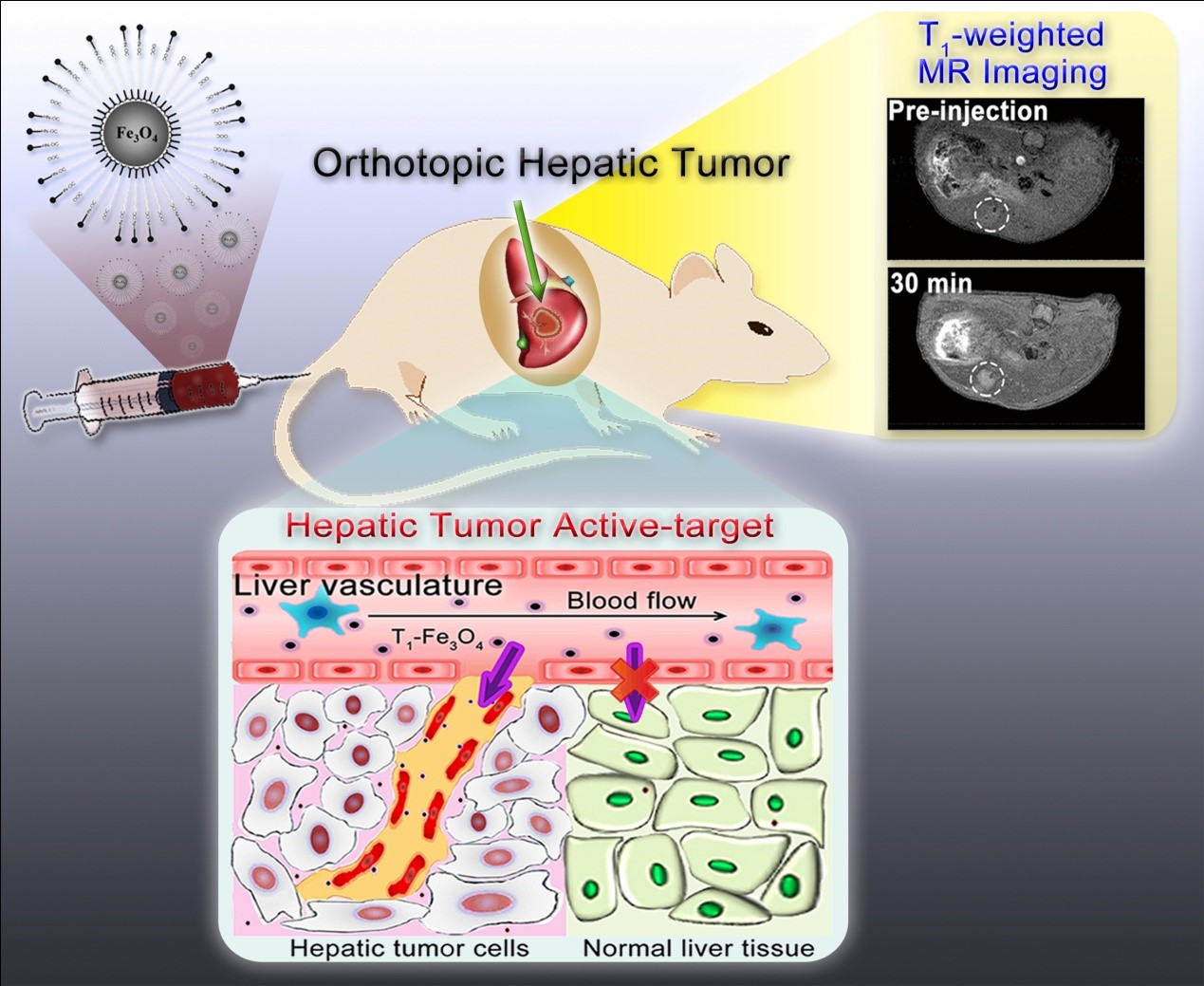
由于肝脏中的血管含量极为丰富,并且其中的血流剪切速率相对较低,因此肝脏是肿瘤发生和转移的高发区域。在过去几十年间,超顺磁性的Fe3O4纳米颗粒作为T2造影剂在肝脏肿瘤的磁共振影像诊断中得到广泛的应用。由于肝脏正常组织中含有大量的巨噬细胞,可对进入机体内的Fe3O4纳米颗粒进行吞噬,在MRI T2加权图像中呈现暗信号。相比之下,肿瘤区域由于缺乏巨噬细胞因而在MRI图像中信号相对不变。由此,便可通过两种明暗信号间的对比可实现对肝脏肿瘤的诊断。但由于该种诊断方式是通过降低正常组织的信号强度来间接对比出病变组织,因此其缺乏对肝脏肿瘤鉴别的特异性。例如,其不能对肝脏肿瘤组织和一些良性病变组织(例如囊肿等等)进行区分。另一方面,由于该种方式是通过肝脏对Fe3O4纳米颗粒的大量吞噬所实现的,对纳米颗粒的过量吸收也会大大增加其在机体内的重金属中毒风险。因此,相关研究领域希望实现针对肝脏肿瘤的主动靶向MRI T1加权成像,来提升肝脏肿瘤磁共振诊断的特异性和准确度,同时降低纳米探针金属毒性的风险。
但实现此过程将面临着重大的挑战。首先,要保证纳米探针靶向至肝脏肿瘤新生血管的过程中不会被肝脏正常组织的巨噬细胞所截留;然后,要确认纳米探针能够特异性地靶向至肝脏肿瘤新生血管这一为数不多的肝脏肿瘤特异性靶点。由于这些困难的存在,目前还未曾有文献报导过实现过对肝脏肿瘤的主动靶向MRI T1加权成像诊断。
本文中通过建立小鼠原位肝癌模型来模拟原发性肝脏肿瘤,同时采用主、被动靶向相比较的方法,来探究RGD修饰的超小磁性Fe3O4纳米探针在肝肿瘤组织的累积效率及其针对肝肿瘤的T1造影增强能力。通过MRI、病理组织定性及定量分析等实验手段验证了RGD修饰的超小磁性Fe3O4纳米探针在小鼠体内不易被MPS所截留、拥有长循环特性的同时,能够实现对肝脏肿瘤的主动靶向MRI T1加权成像。相较于传统的肝肿瘤MRI T2加权造影模式——使肝正常组织变暗,这种创新的造影模式能够更加有效、更加准确地对更加微小的肝肿瘤(文章中肝肿瘤直径约为2.2 mm)进行诊断。本文中首次实现对肝脏肿瘤组织的主动靶向MRI T1加权成像,这不仅大大提升了肝脏肿瘤磁共振诊断的准确度和灵敏度,同时有效地降低了由注射纳米探针所带来的潜在金属毒性风险,因此其将在肝肿瘤的早期诊断中表现出巨大的优势。
文章已在Theranostics在线。
Zhengyang Jia, Lina Song, Fengchao Zang, Jiacheng Song, Wei Zhang, Changzhi Yan, Jun Xie, Zhanlong Ma, Ming Ma, Gaojun Teng, Ning Gu* and Yu Zhang*. Active-target T1-weighted MR Imaging of Tiny Hepatic Tumor via RGD Modified Ultra-small Fe3O4 Nanoprobes. Theranostics, 2016, 6(11): 1780. doi: 10.7150/thno.14280