磁性纳米材料用于肿瘤诊断与治疗的可行性已被广泛证实。作为一类具有临床医学诊疗用的特殊材料,高性能是其发挥疗效的一个重要的特性。虽然这类材料具有良好的生物相容性,但过度使用会造成人体铁过载而引起并发症。故在实际临床应用时,安全性剂量的考虑是个不容忽视的问题。而高性能磁性纳米材料的出现便可以在达到良好诊疗效果的前提下,通过减少给药的剂量,将其副作用降低到最小。
在磁性纳米材料介导的肿瘤诊疗中,除了材料的高性能以外,材料对于肿瘤的特异靶向能力也是至关重要的。目前限制其临床应用的重大障碍是材料在肿瘤部位不能达到足够的浓度。在以往的研究中,无特定靶向分子修饰的磁性纳米材料可借助于特有的EPR效应被动靶向累积于肿瘤部位中,这也是当前多数纳米药物肿瘤治疗采取的常规给药途径。然而,被动靶向磁性纳米颗粒易被肝、脾、肺、骨髓等RES的巨噬细胞吞噬,故在肿瘤内富集的浓度相当少。为了提高材料的肿瘤靶向效果,选择特定的主动靶向配体(如抗体、转铁蛋白、叶酸、短肽等)进一步表面偶联是一种行之有效的方法。这种功能化后的磁性纳米材料,靶向性选择结合特定肿瘤细胞,可以提高材料在肿瘤处的浓度和富集时间。依靠磁性纳米颗粒主动靶向性,可较好地实现细胞内靶向热疗,提高肿瘤治疗的疗效。
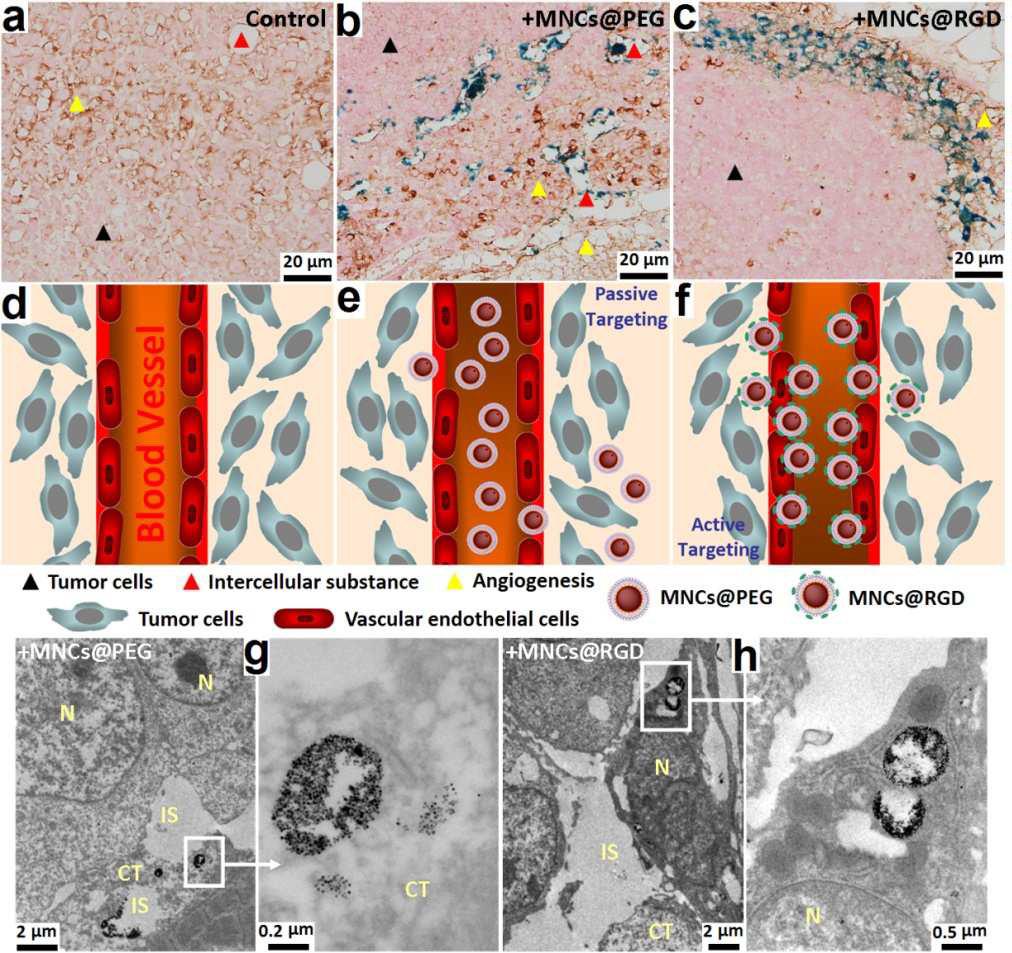
在主动靶向配体中,RGD是一类含有精氨酸−甘氨酸−天冬氨酸序列的短肽,可与细胞表面的整合素αvβ3特异性结合。一般来说,整合素在细胞黏附、增殖、分化、转移、凋亡等过程中起着重要的调控作用,而αvβ3作为其中一种整合素,其在肺癌、乳腺癌、骨肉瘤、膀胱癌、前列腺癌、胶质母细胞瘤等多种实体肿瘤细胞表面有高水平的表达。此外,整合素αvβ3在上皮细胞和成熟的内皮细胞呈低表达,但在活化的肿瘤血管内皮细胞及某些肿瘤细胞中具有高表达。因此,选择RGD短肽作为主动靶向配体偶联到磁性纳米颗粒表面,可实现对肿瘤新生血管内皮细胞较强的靶向效应,从而用于对肿瘤血管的靶向显影,有望对肿瘤进行早期诊断及疗效评估。
在肿瘤靶向热疗(TMH)领域,主动靶向型的磁性纳米材料在交变磁场(ACMF)作用下介导的肿瘤细胞内磁感应治疗,是目前磁热疗发展的趋势。然而,最近有研究表明,相比于被动靶向型纳米颗粒,主动靶向型的纳米颗粒在肿瘤组织内靶向累积的量并没有明显增多。原因在于纳米材料表面偶联的靶向配体,如功能性抗体、多肽等,在进入血液循环系统时,会加速纳米颗粒的调理作用(如血红蛋白的吸附)而被清除。这在很大程度上消弱了纳米颗粒的靶向能力,使其最后到达靶部位的量非常少。基于这一点,我们以合成出的单包覆PEG化磷脂磁性纳米晶(MNCs@PEG)为基础,进一步在其表面磷脂的PEG链末端不完全偶联RGD分子,并在磷脂疏水链间负载荧光分子吲哚菁绿(ICG),合成出表面同时含有PEG分子和RGD分子的双模态(磁学/光学)功能性磁性纳米晶(MNCs@RGD),一方面发挥其双模态的分子成像功能,用于肿瘤的早期诊断,另一方面发挥其EPR效应介导的被动靶向和与肿瘤新生血管内皮细胞特异性结合的主动靶向作用,增强对肿瘤的靶向能力,达到在肿瘤组织内的充分富集,为达到高效的肿瘤TMH疗效提供基础。
我们工作的创新点在于通过介导材料的MRI/体内荧光成像,实时、原位地监控纳米晶在肿瘤区域的定位、富集,评价了肿瘤的形态和大小,以此作为肿瘤的诊断手段,结合肿瘤的TMH,初步设计了肿瘤诊疗一体化的优化方案,例如多次给药、持久和重复的热疗等。此外,我们系统地比较了MNCs@PEG介导的被动靶向和MNCs@RGD介导的主动靶向(肿瘤新生血管靶向)效果和磁性纳米晶在肿瘤内的组织和细胞定位及滞留时间。相比于MNCs@PEG,MNCs@RGD介导的主动靶向MRI成像效果更加明显,对肿瘤的诊断起到良好的作用。原因在于MNCs@RGD同时具备PEG长链和RGD靶向分子,因此可促进EPR介导的肿瘤被动靶向和定位于肿瘤脉管的主动靶向能力。
然而,由于MNCs@RGD仅靶向于肿瘤新生血管,还没能完全达到细胞内的靶向,故其在主动TMH方面,与MNCs@PEG相比,肿瘤生长的抑制优势并不十分突出。但我们相信,将来这种功能型磁性纳米晶可结合靶向药物分子,发挥热疗和化疗的协同作用,可作为一种具有前途的肿瘤诊疗试剂而应用于临床医学领域。
该成果在线发表于Nanoscale, 2016, Accepted Manuscript, DOI: 10.1039/C6NR03916B,http://pubs.rsc.org/en/content/articlelanding/2016/nr/c6nr03916b/unauth#divAbstract。