口腔和颅面组织修复需要抵御微生物的不利影响和满足生物力学特性,提出了独特的组织工程挑战。小分子药物是增强第三代组合组织工程支架生物和再生潜力的理想载体。小分子被纳入可吸收和生物活性支架设计中,已成为干细胞生长和分化的高选择性调节剂。溶血磷脂酸(LPA)作为一种天然的生物活性脂质,在成骨细胞生物学中的具有多种生理功能。LPA最近被报道为成骨细胞中核苷酸偶联成骨活性的一种自分泌介质,它在调节破骨细胞功能方面也有潜在的作用。小分子PFI-2是间充质干细胞衰老过程中组蛋白甲基转移酶SETD7的一种抑制剂。
课题组周雪锋老师与苏州大学附属第二医院钱蕴珠主任医师、伊利诺伊大学芝加哥分校栾向红教授合作,分采用LPA和PFI-2作为活性作分,设计具有多功能的三维支架材料,评价其在口腔组织再生的效能。首先,我们开发了一种融合溶血磷脂酸(LPA) 纳米颗粒、氧化锌(ZnO) 纳米颗粒和去铁胺(DFO) 纳米颗粒的模拟细胞外基质的同轴静电纺丝支架。PP-LPA-ZnO/DFO支架在体内体外研究中展现了良好的成骨性能、血管生成能力和抑菌性,能够满足工程生物支架在骨再生复杂微环境中的要求。
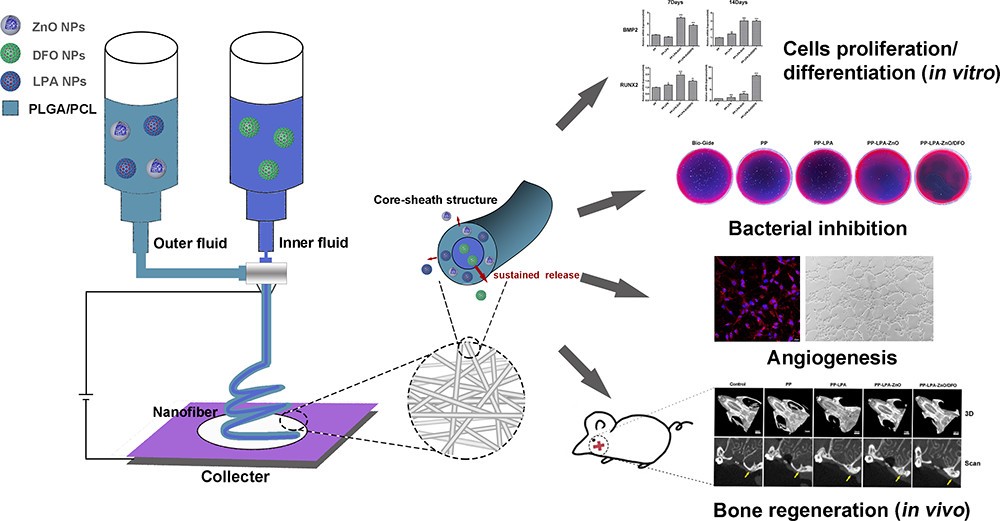
图 在LPA仿生支架的设计示意图和体内体外评价
LPA相关工作“Spatial Delivery of Triple Functional Nanoparticles via an Extracellular Matrix-Mimicking Coaxial Scaffold Synergistically Enhancing Bone Regeneration”目前已被《ACS Appl. Mater. Interfaces》接收并在线发表: https://doi.org/10.1021/acsami.2c08784
此外,我们制备了基于PLGA-PCL静电纺丝支架,通过多巴胺PDA和胶原蛋白涂层增强,以改善生物相容性和可吸收性,并双重浸染小分子PFI-2,以促进早期释放和长期持续释放,确保在组织再生的关键阶段小分子介质的可用性。可降解PLGA-PCL支架和PFI-2小分子触发物的组合抑制SetD7甲基转移酶,并成功促进β-Catenin通路介导的组织再生。
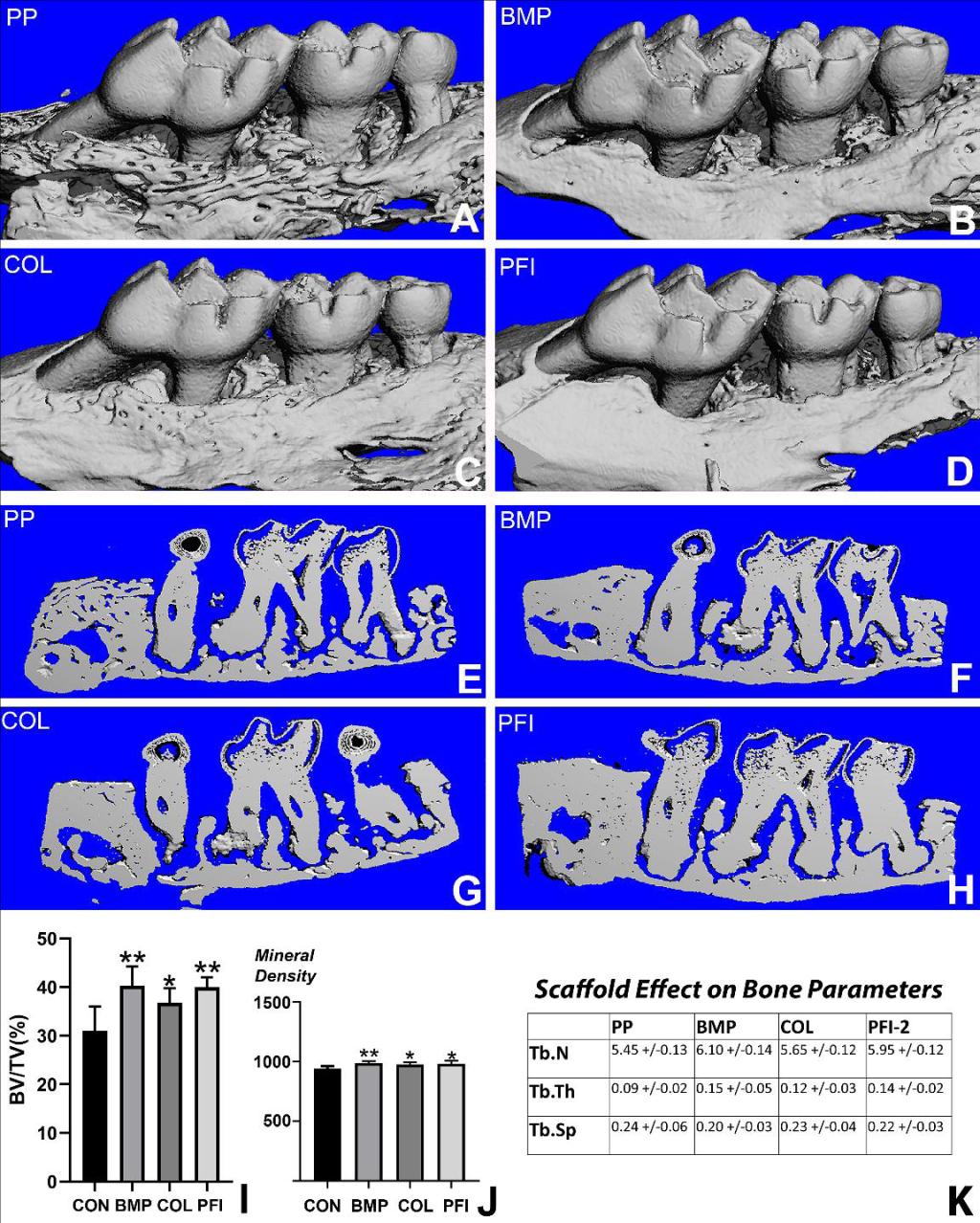
图 载PFI-2的仿生支架成骨性能Micro-CT结果与分析
PFI-2相关工作“Long-acting PFI-2 small molecule release and multilayer scaffold design achieve extensive new formation of complex periodontal tissues with unprecedented fidelity”目前已被《Biomaterials》接收并在线发表: https://doi.org/10.1016/j.biomaterials.2022.121819