工程化细胞外泌体正在成为药物输送、疾病诊断、免疫治疗和精准医疗的理想囊泡纳米平台,目前传统的外泌体工程化方法通常会破坏外泌体膜和其内部的生物活性分子。氧化铁纳米颗粒(IONPs)由于其磁性,通常用作成像试剂和靶向治疗的纳米载体,但其较大尺寸影响了外泌体的内在生物分子活性,限制了其进一步应用。在本研究中,我们提出了纳米材料辅助细胞生物反应器修饰外泌体的概念:以巨噬细胞作为生物反应器,使用粒径<5nm的超顺磁性氧化铁纳米颗粒(ESIONPs)诱导巨噬细胞M1极化,并从中分离出工程化巨噬细胞外泌体(ESIONPs@EXO)。这个生物过程,保证了巨噬细胞外泌体的完整性和内在生物活性。为了评估ESIONPs@EXO的生物学功能,我们进行了一系列体内外功能及分子机制实验。研究结果表明ESIONPs@EXO在体外可以抑制血管内皮细胞(ECs)的增殖、迁移、成管和发芽,表现出良好的抗新生血管生成性能。向病理性新生血管模型小鼠体内注射ESIONPs@EXO后,ESIONPs@EXO靶向聚集于病理性新生血管周围且抑制体内病理性新生血管,并表现出良好的生物相容性;同时,ESIONPs@EXO处理后的模型小鼠在磁共振成像中表现出优异的T1-MRI对比特性。在机制上,ESIONPs@EXO诱导内皮细胞铁死亡并表现出免疫治疗能力。
总的来说,本研究采用生物学方法设计出了一种具有MRI成像、诱导铁死亡和免疫治疗等多种功能的工程化细胞外泌体—ESIONPs@EXO,以血管性视网膜病变和葡萄膜黑色素瘤的病理性血管生成为靶点,通过不依赖VEGF的机制抑制血管生成。因此,它可以为治疗病理性血管生成提供一种有效的策略,具有临床转化的潜力。
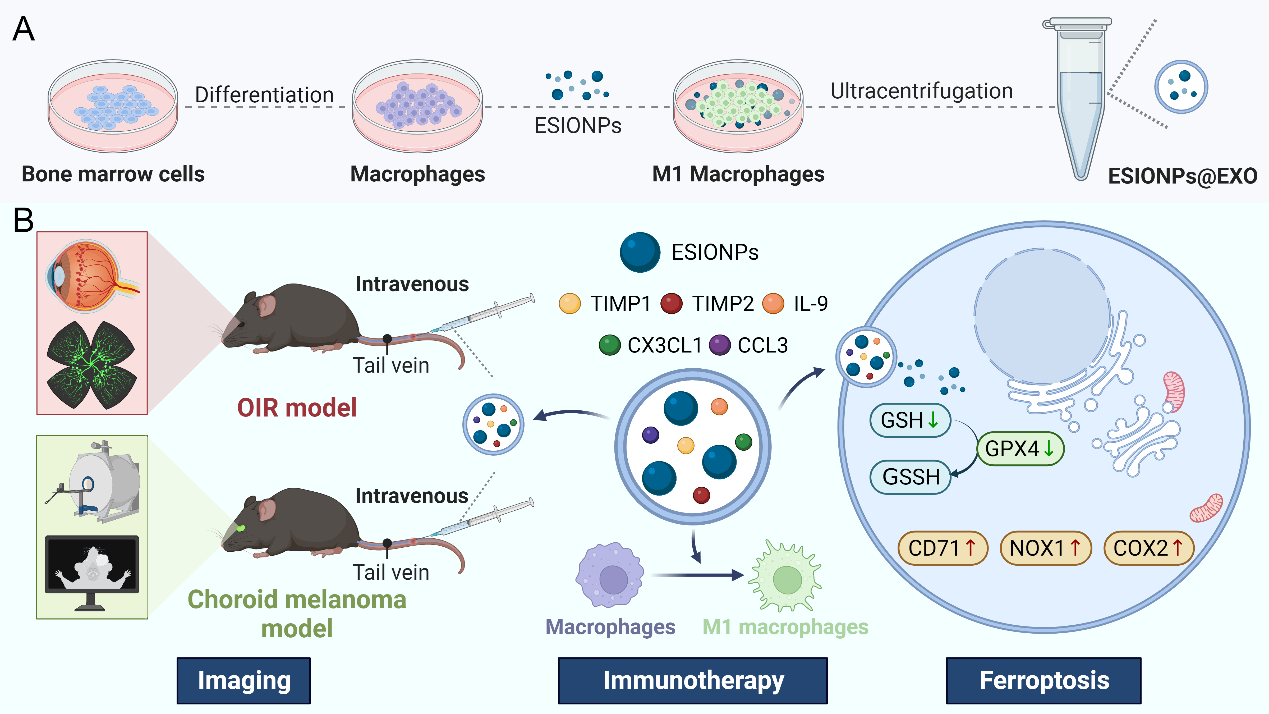
ESIONPs@EXO制备(A)和靶向病理性血管生成治疗(B)的示意图
该工作由顾宁教授团队与上海长海医院宋洪元主任团队合作完成,论文已在《ACSNano》在线发表:Haorui Zhang†,Yu Mao†, Zheng Nie†, Qing Li, Mengzhu Wang, Chang Cai, Weiju Hao, Xi Shen,Ning Gu*, Wei Shen*, and Hongyuan Song*. Iron Oxide Nanoparticles Engineered Macrophage-Derived Exosomes for Targeted Pathological Angiogenesis Therapy. ACS Nano. 2024 Feb 27.Epub ahead of print. PMID: 38412252.文章链接:https://doi.org/10.1021/acsnano.4c00699