心肌缺血再灌注损伤是指在冠状动脉发生部分或完全急性阻塞后,虽然缺血心肌得以恢复正常灌注,但其组织损伤却进一步加重的复杂病理过程。这一过程的发病机制十分复杂,目前研究较多的机制包括氧化应激、炎症浸润和钙超载。其中,抗氧化应激和抗炎治疗被认为是心肌缺血再灌注损伤的首选治疗方案。普鲁士蓝纳米酶因具有类过氧化氢酶(ACT)和类超氧化物歧化酶(SOD)等多酶活性,在抗氧化应激和抗炎方面展现了显著的效果,因此普鲁士蓝纳米颗粒对心肌缺血再灌注损伤表现出良好的治疗潜力。
近期,本团队开发了一种使用聚葡萄糖山梨醇羧甲基醚(PSC)包覆的普鲁士蓝纳米酶(PBNz@PSC),用于小鼠心肌缺血再灌注损伤的治疗。该研究表明PBNz@PSC由于PSC表面包覆表现出增强的类SOD酶活,并且具有良好的生物相容性和安全性。在体内外实验证明了PBNz@PSC具有优异的活性氧(ROS)清除和抗炎作用,能够逆转心肌损伤、减少心肌梗塞和冠状动脉微血管阻塞(MVO)的发生、以及降低心肌纤维化,最终有效改善心功能。
该研究还揭示了PBNz@PSC在心肌缺血再灌注损伤(MIRI)治疗中的多重作用机制。首先,注射PBNz@PSC后,EPR效应引导其通过受损的血管网络优先靶向并聚集在受损的心肌组织中。进入心肌细胞后,PBNz@PSC利用其类CAT和SOD酶活清除ROS,从而产生氧气以缓解梗死心肌内的缺氧。另一方面,PBNz@PSC可以激活AMPK信号通路,促进eNOS的表达,产生NO以舒张血管,并抑制NF-κB信号通路,下调促炎细胞因子(IL-6、IL-1β和TNF-α)的转录,发挥抗炎作用。此外,PBNz@PSC清除ROS产生的氧气和NF-κB通路的抑制导致HIF-1α表达降低,这进一步导致促炎因子iNOS表达降低,提供了额外的抗炎作用。这一系列相互关联的作用最终阻止了心肌细胞凋亡和坏死,成功挽救了受损的心肌。
PBNz@PSC的研究不仅为纳米酶在生物医学领域的应用提供了新的范例,也为心肌缺血再灌注损伤的治疗开辟了新的方向。随着研究的深入,PBNz@PSC有望成为新一代治疗心肌缺血再灌注损伤的有效工具,为患者带来福音。该工作以“Prussian Blue Nanozyme Featuring Enhanced Superoxide Dismutase-like Activity for Myocardial Ischemia Reperfusion Injury Treatment”为题目发表在ACS Nano杂志上,论文第一作者是东南大学生物科学与医学工程学院博士生龙朦朦,通讯作者为南京大学医学院顾宁教授、南京大学附属鼓楼医院心内科徐标教授和东南大学生物科学与医学工程学院何泓良教授。该研究感谢国家自然科学基金、科技部国家重点研发计划、江苏省前沿基础研究计划和南京市科技发展基金的资助。
文章链接:https://doi.org/10.1021/acsnano.4c14445
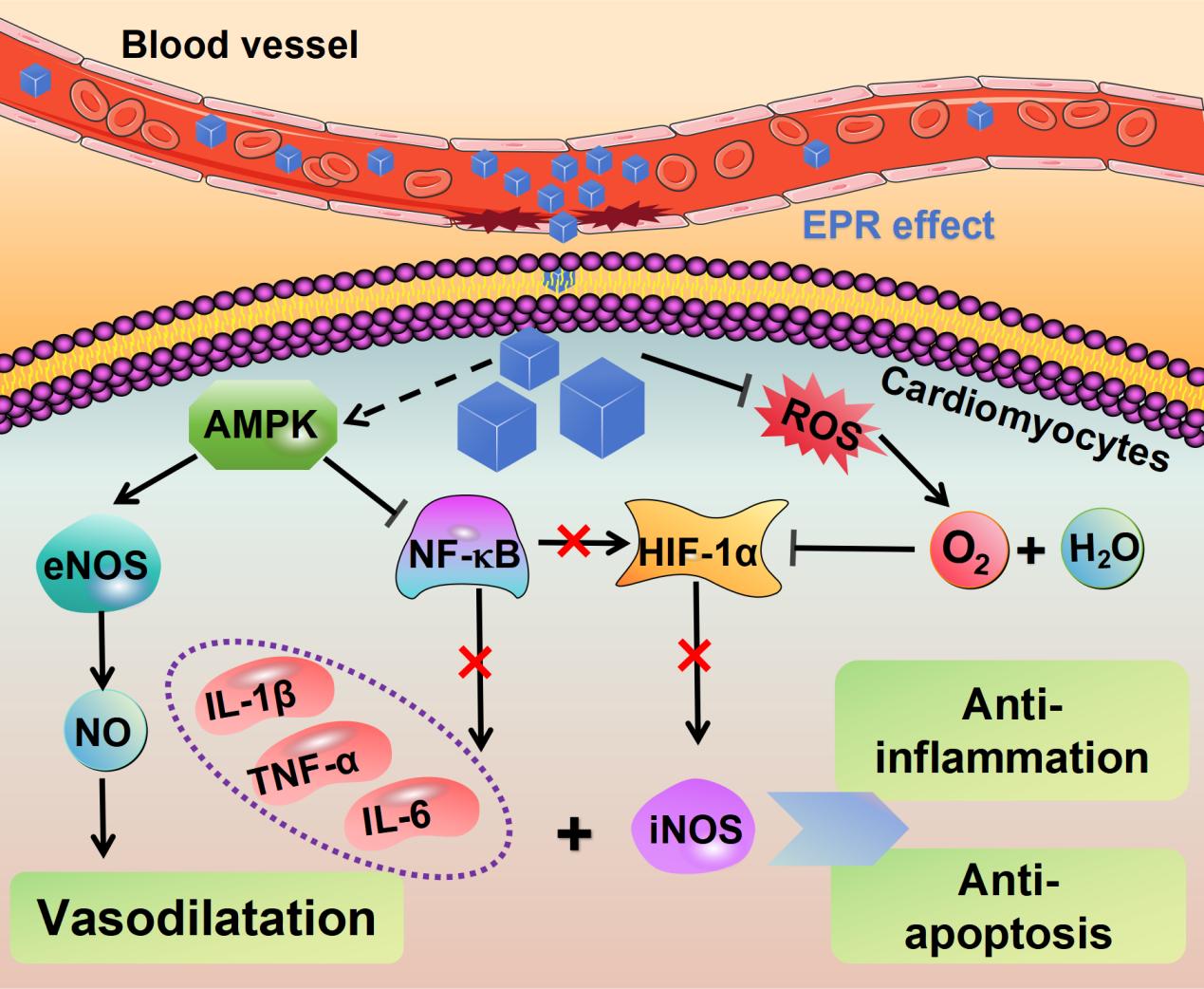
图1. PBNz@PSC治疗心肌缺血再灌注损伤的可能机制。